Цемент с жидким стеклом: пропорции, применение, приготовление
Воздействие на бетонную поверхность негативных внешних факторов приводит к ухудшению технических характеристик покрытия. Применение жидкого стекла в бетоне поможет повысить сопротивляемость возводимой или готовой конструкции к негативному воздействию осадков, резких перепадов температур и других факторов, под влиянием которых свойства поверхностей из бетона существенно ухудшаются. Перед тем как начать использовать такую защитную смесь, рекомендуется изучить ее технические характеристики, правила приготовления, а также плюсы и минусы применения.
Что собой представляет?
В классических бетонных смесях основными компонентами выступают:
- песок;
- цемент;
- щебень.
Увеличить сроки эксплуатации сооружения поможет добавление в строительный раствор жидкого стекла.
Добавив к сухому составу воду, удастся получить прочный строительный материал для заливки фундамента, бетонного пола, а также возведения конструкций различного предназначения. Однако иногда физико-технических свойств такого бетона недостаточно, чтобы сооружение надежно выполняло свои функции. Для улучшения технических характеристик раствора используется специальная добавка в бетон на основе жидкого стекла. Получается надежное, устойчивое к воздействию негативных внешних факторов покрытие, благодаря которому конструкция прослужит намного дольше заявленного срока.
Однако иногда физико-технических свойств такого бетона недостаточно, чтобы сооружение надежно выполняло свои функции. Для улучшения технических характеристик раствора используется специальная добавка в бетон на основе жидкого стекла. Получается надежное, устойчивое к воздействию негативных внешних факторов покрытие, благодаря которому конструкция прослужит намного дольше заявленного срока.
Свойства материала
Использование жидкого стекла в бетоне позволяет добиться таких результатов:
- Увеличить влагостойкость. Такая защита необходима для сооружений, постоянно контактирующих с водой. Это может быть бассейн, сырой подвал, резервуары, кольца колодца и т. д.
- Ускорить застывание. Если приготовить классический бетонный раствор с использованием пропитки, время для твердения готового состава намного сократится. Достаточно будет 24 ч., чтобы поверхность стала готовой к дальнейшим строительным работам, в то время как обычный раствор сохнет 3—5 дней.

- Повысить гидроизоляционные свойства. Жидкое стекло для гидроизоляции бетона добавляют для предотвращения появления плесени и грибков на поверхности. Дело в том, что особый состав изделия имеет бактерицидное воздействие, благодаря которому шансов на развитие и размножение у микроорганизмов нет.
- Повысить жаропрочность. Поверхность, на которую наносят обычный бетонный раствор, может устоять при температуре до 200 °C, если больше, штукатурный слой разрушится. Но когда добавлять в раствор жидкостекольное средство и обработать им конструкцию, оно сможет выдержать температуры 1400 градусов и больше. Поэтому при строительстве камина или печи целесообразно приготовить цементный раствор с жидким стеклом.
Применение
Водоотталкивающие свойства материала позволяют использовать его при сооружении чаш для бассейна или при гидроизоляции фундамента.
Сферы применения этого качественного материала обширные. Изделие предназначено для следующих целей:
- Изготовление бетона, обладающего специальными характеристиками, такими как морозостойкость, огнестойкость, кислотоупорность.

- Гидроизоляция фундамента, если он обустроен в месте неглубокого залегания грунтовых вод.
- Гидроизоляция стен, подвальных помещений, стяжки полов.
- Обустройство чаш бассейна, стенок колодцев.
- Производство штукатурки, обладающей водоотталкивающими свойствами.
- Изготовление огнеупорного раствора для оштукатуривания и заделки стыков при обустройстве каминов, печей, барбекю.
Преимущества и недостатки
Жидкое стекло для бетона обладает рядом преимуществ, среди которых главными являются такие:
- многофункциональность;
- повышение адгезии;
- образование на поверхности оболочки, надежно защищающей поверхность от грунтовой и атмосферной влаги;
- надежная защита и укрепление обработанной конструкции;
- быстрые сроки затвердения;
- несложное приготовление и нанесение;
- доступная цена.
Бетонная смесь с добавкой быстро затвердевает, поэтому работать с ней надо поспешно.
Однако прежде чем проводить железнение бетона жидким стеклом, необходимо взвесить все за и против, потому что помимо достоинств, такой способ защиты имеет и недостатки. Основными считаются такие:
Основными считаются такие:
- Быстрое затвердение, из-за чего процесс заливки может утрудниться, потому что работать придется быстро.
- Узконаправленность. Наносить материал в целях влагозащиты целесообразно только на бетонную и деревянную поверхность. Для других видов строительных растворов он не подходит.
- Необходимость строгого соблюдения пропорции. Если инструкция приготовления смеси не соблюдается, готовый раствор получится малоэффективным.
Приготовление раствора
Инструменты и материалы
Технология изготовления бетонной смеси с добавлением жидкого стекла несложная. Сделать раствор можно и своими руками, но прежде следует подготовить инвентарь:
- емкость для замешивания раствора;
- специальная насадка на дрель, благодаря которой удастся быстро смешать компоненты;
- кисть, валик или пульверизатор;
- уровень, с помощью которого контролируется горизонталь или вертикаль обрабатываемой поверхности.
Раствор с жидким стеклом не делается в бетономешалке, потому как процесс застывания происходит раньше окончания приготовления.
Бетономешалка для смешивания компонентов раствора не подойдет, потому что раствор начнет затвердевать еще до окончания приготовления. С помощью механической мешалки можно лишь соединить все материалы, но без добавления жидкого стекла. Затем нужное количество пропитки добавляется и перемешивается вручную. Из материалов понадобятся:
- цемент;
- просеянный песок;
- чистая вода.
Расчеты и пропорции
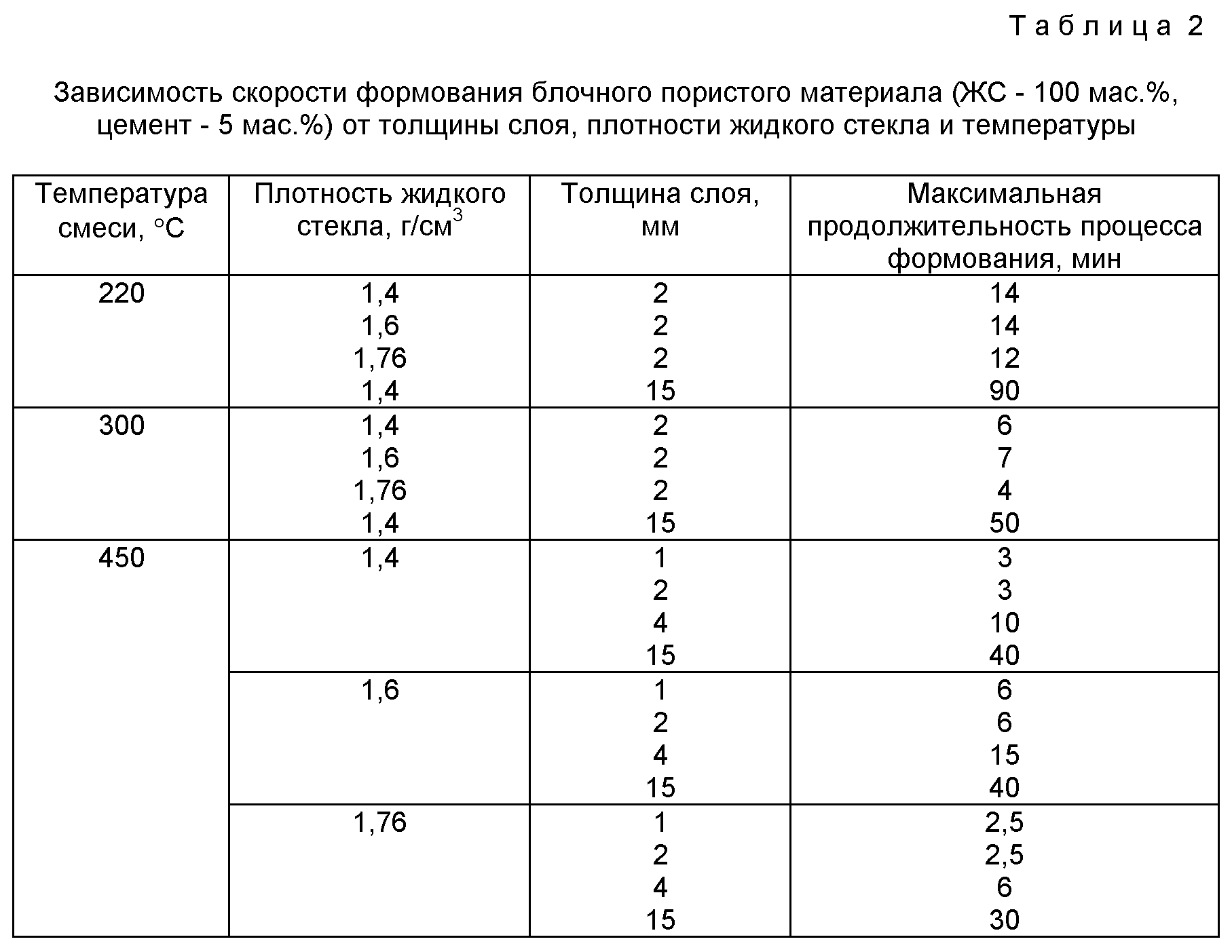
Чтобы правильно рассчитать пропорции жидкого стекла в общей массе раствора, важно определиться, за какой промежуток времени состав должен застыть. Исходя из этого критерия, рекомендуется изучить таблицу:
| Расход жидкого стекла, % | Начальное схватывание, мин. | Окончательное застывание, час. |
| 2 | 40—45 | 20—24 |
| 5 | 25—30 | 14—17 |
| 8 | 10—15 | 6—8 |
| 10 | 5—10 | 2—4 |
Распространенное соотношение цемента, песка и жидкостекольной пропитки такое:
Гидроизоляционное покрытие со специальной добавкой готовиться с разбавлением в одной литре воды.
- Для изготовления надежного гидроизоляционного покрытия необходимо разводить жидкое стекло в 1 литр воды.
- Для получения пластификатора универсального назначения требуется смешать цемент и песок (пропорция 1:3), затем добавить к ним силикатный материал объемом 1/5 от общего количества массы.
- Если нужно покрыть и пропитать готовую оштукатуренную поверхность, вода и жидкостекольная пропитка смешиваются в соотношении 5:1 соответственно. Затем готовый раствор нужно нанести на бетон.
- Для приготовления огнеупорного раствора в стандартную цементно-бетонную смесь добавляется до 5% силикатной пропитки.
Приготовление: основные правила
Обработка бетона жидким стеклом будет проходить быстро и качественно, если масса будет приготовлена правильно. Порядок действий такой:
- Приготовить 10 л чистой, профильтрованной воды. Техническая вода не подойдет, потому что соли и другие примеси, содержащиеся в ней, негативно влияют на реакцию.
- Набрать в стакан жидкое стекло и аккуратно лить его в воду, осторожно перемешивая состав до получения однородной консистенции.

- Готовый раствор перелить в таз, а после, аккуратно перемешивая все, добавить цементно-песчаную смесь в рассчитанных пропорциях. Добавление жидкого стекла в бетон без предварительного разведения в воде запрещено, потому что готовое изделие не будет соответствовать заявленным характеристикам.
- Взбить массу строительным миксером или дрелью со специальной насадкой.
- Готовым изделием заливается горизонтальная поверхность, например, опалубка или им можно покрыть стены.
Вертикальная поверхность после обработки жидким стеклом станет абсолютно гладкой. Если планируется дополнительная декоративная отделка, то для создания шершавости и надежной сцепки с применяемым материалом, рекомендуется дополнительно покрыть стену строительным средством «Бетоноконтакт».
Техника безопасности
Жидкое стекло не относится к веществам, обладающим высоким уровнем токсичности. Но если материал попадает на кожу или слизистую, он вызывает раздражение. Чтобы избежать травмирования, во время работы следует использовать спец. одежду, на руки надевать специальные перчатки, а глаза защищать защитными очками. Помещения, где проводятся строительные работы с использованием жидкого стекла, должны постоянно проветриваться. Если случилось так, что готовый раствор попал на кожные покровы, необходимо обработать поврежденный участок слабым раствором уксуса, разведенным в чистой воде.
Чтобы избежать травмирования, во время работы следует использовать спец. одежду, на руки надевать специальные перчатки, а глаза защищать защитными очками. Помещения, где проводятся строительные работы с использованием жидкого стекла, должны постоянно проветриваться. Если случилось так, что готовый раствор попал на кожные покровы, необходимо обработать поврежденный участок слабым раствором уксуса, разведенным в чистой воде.
Какая правильная пропорция цемента с жидким стеклом?
В строительстве, а также при ремонте внутренних помещений повсеместно используются смеси на основе цемента и жидкого стекла. При этом, несмотря на особые условия приготовления и нанесения, получаемые таким образом антисептические, гидрофобные, кислотоупорные и огнезащитные свойства конструкций преобладают над сложностями и недостатками. Для строительных и ремонтных технологий применяют несколько видов составов, состоящие из цемента, просеянного песка и жидкого стекла, смешанных в определенных пропорциях.
Для строительных и ремонтных технологий применяют несколько видов составов, состоящие из цемента, просеянного песка и жидкого стекла, смешанных в определенных пропорциях.
Раствор для гидроизоляции
Для обустройства водонепроницаемого слоя используют раствор, состоящий из жидкого стекла и цемента взятых в пропорции 1:10.
Если в инструкции по приготовлению стоят пропорции компонентов «по массе», следует пользоваться следующими величинами:
- Жидкое стекло: 1,5 кг/л:
- Часть цемента смешанная с 4 частями песка: 2,5-2,7 кг/л;
Полученную смесь используют для строительства наливных полов и повышения гидроизоляционных качеств стен зданий и сооружений.
Раствор для наружных работ
Водонепроницаемая (гидрофобная) штукатурка используется для защиты основного материала стен зданий и сооружений от губительного воздействия воды и повышенной влажности воздуха.
Особенно актуально использование гидрофобного защитного слоя в северных регионах России – регулярное замерзание и оттаивание влаги находящейся внутри стен обычно приводит к появлению трещин и последующему разрушению конструкции.
Для самостоятельного приготовления гидрофобной штукатурки рекомендуются следующие пропорции жидкого стекла, цемента и просеянного песка: 1:2:5.
Раствор для грунтования
В домашнем строительстве и ремонте иногда возникает необходимость покрыть грунтом бетонную стяжку. Для этих целей готовят раствор из жидкого стекла и цемента, замешанный в пропорции 1:1.
Пропорции раствора для ремонтных работ
Раствор, приготовленный из жидкого стекла и цемента можно использовать для замазки трещин, пустот и щелей. Материал готовится из жидкого стекла, портландцемента и просеянного песка смешанный в пропорциях: 1:1:3.
Приготовленный таким образом раствор имеет густую консистенцию, благодаря чему хорошо держится в дефектах поверхности и большое содержание жидкого стекла способствует быстрому его «схватыванию» и затвердеванию.
Влияние жидкого стекла на свойства цементного раствора
Жидкое стекло используется как добавка в различные строительные смеси. Основное предназначение – создание поверхностного защитного покрытия, оно предотвращает проникновение влаги и улучшает декоративные качества материала. Жидкое стекло и цемент в соответствующей пропорции придают полезные свойства готовому материалу: антисептические, кислотоупорные, гидрофобные и огнезащитные качества.
Основное предназначение – создание поверхностного защитного покрытия, оно предотвращает проникновение влаги и улучшает декоративные качества материала. Жидкое стекло и цемент в соответствующей пропорции придают полезные свойства готовому материалу: антисептические, кислотоупорные, гидрофобные и огнезащитные качества.
Блок: 1/8 | Кол-во символов: 398
Источник: https://pobetony.expert/poleznye-stati/zhidkoe-steklo-i-cement
Общая информация
Существует множество способов получения цементных растворов. Для каждой конкретной задачи используется определенный тип раствора. Обычный цементо-песочный раствор – это смесь цемента песка и воды в требуемых пропорциях. Бетон отличается тем, что в его состав входит щебень требуемой фракции. Простые цементо-песочные смеси и бетоны производятся с различным соотношением составляющих, а иногда вносятся и дополнительные добавки. К числу специальных добавок можно отнести пластификаторы, вещества для гидроизоляции, компоненты которые делают раствор морозоустойчивым и т. д.
д.
Жидкое стекло используется при изготовлении жаропрочного бетона, а также в качестве гидроизоляции бетонных полов и стен.
Одной из наиболее часто применяемых добавок в раствор является жидкое стекло. Есть множество теорий и мнений о конечных свойствах цементного раствора после применения этого вещества.
По своей сути жидкое стекло – это водный раствор с силикатом натрия или калия. Получают его из кремнезема. В промышленной сфере используют как составляющее вещество для получения кирпича или бетонных изделий, которые применяют в агрессивных кислых средах. В бытовой сфере эту добавку используют для придания влагозащитных свойств раствору и для увеличения его прочности. Также в некоторых случаях силикат натрия используется для ускорения затвердевания раствора. Жидкое стекло представляет собой густую жидкость желтовато-белого цвета. В торговые сети поставляется в емкостях различного объема.
Схема применения жидкого стекла.
Применение силиката натрия в виде добавок к цементным растворам и бетонам должно быть оправдано в конечном результате. В связи с тем что при ведении строительных работ бетон и простой цементный раствор являются главнейшими составляющими, следует очень осторожно подходить к выбору добавочных компонентов для растворов. К примеру, бетон, применяемый для фундаментных работ, должен обладать определенными заданными характеристиками, а отделочные растворы на основе цемента производятся уже с совершенно другими физическими характеристиками. Бывают ситуации, когда требуется провести ремонтные работы небольшого объема или работы, на выполнение которых существует малый запас времени. То есть каждая добавка в растворе несет определенную функцию и может при разных назначениях строительной смеси принести как пользу, так и вред.
В связи с тем что при ведении строительных работ бетон и простой цементный раствор являются главнейшими составляющими, следует очень осторожно подходить к выбору добавочных компонентов для растворов. К примеру, бетон, применяемый для фундаментных работ, должен обладать определенными заданными характеристиками, а отделочные растворы на основе цемента производятся уже с совершенно другими физическими характеристиками. Бывают ситуации, когда требуется провести ремонтные работы небольшого объема или работы, на выполнение которых существует малый запас времени. То есть каждая добавка в растворе несет определенную функцию и может при разных назначениях строительной смеси принести как пользу, так и вред.
Блок: 2/4 | Кол-во символов: 2350
Источник: http://o-cemente.info/izgotovlenie-betona/vliyanie-zhidkogo-stekla-na-svoystva-ce.html
Процесс приготовления
Как сделать самостоятельно раствор с добавлением силикатов? Соблюдайте последовательность операций:
- возьмите одно ведро чистой воды;
- добавьте стакан силиката;
- перемешайте, полностью растворив средство;
- перелейте смесь;
- введите, при помешивании, сухую цементно-песчаную смесь;
- используя смеситель, взбейте массу до однородности;
- заполняйте массой подготовленный объем.

На таком цементном растворе, приготовленном небольшими порциями, будет обеспечено высокое качество строительных работ.
Блок: 2/4 | Кол-во символов: 510
Источник: https://pobetony.ru/raschet/zhidkoe-steklo-cement-proporcii/
Целесообразность использования, альтернативные варианты
Применение оправдано прежде всего при проведении аварийных ремонтных работ, а именно – устранении течей в гидротехнических сооружениях. В частном строительстве жидкое стекло добавляют в цемент с целью:
- Получения бюджетного состава для гидроизоляции бетонных поверхностей: стяжек, стен колодцев или подвалов, перекрытий.
- Замеса водостойких штукатурок.
- Приготовления кладочных смесей для этих же конструкций или ремонтных для заделки и замазки стыков.
- Гидроизоляции и герметизации стен бассейнов.
- Получения растворов для обмазки каминов и дымоходов.

- Улучшения характеристик обычного бетона.
При самостоятельном приготовлении аварийных смесей силикаты натрия следует развести с цементом и песком в пропорции о т 1:5 до 1:1. Они схватываются в течение считанных минут даже при условии открытых течей. Потребность в применении возникает при повреждении бетонных канализационных труб, септиков, колодцев и аналогичных гидросооружений, но в целом нет никаких ограничений для проведения плановых ремонтов.
Технология смешивания с цементом
Достигаемый эффект напрямую зависит от пропорций компонентов и концентрации силикатов. Жидкое стекло используется как в качестве добавки в штукатурки, так и вещества для обработки эксплуатируемых конструкций, набравших прочность.
| Цель ввода | Пропорции жидкого стекла с остальными компонентами | Особенности смешивания |
| Получение влагостойкой штукатурки | 15 % | Водный концентрат вводится в готовую смесь ПЦ и песка с соотношением 1:2,5 |
| Приготовление грунтовки | Равные соотношения с цементом | Силикаты натрия следует развести в ¼ от общей дозы воды и соединить с заранее затворенным раствором.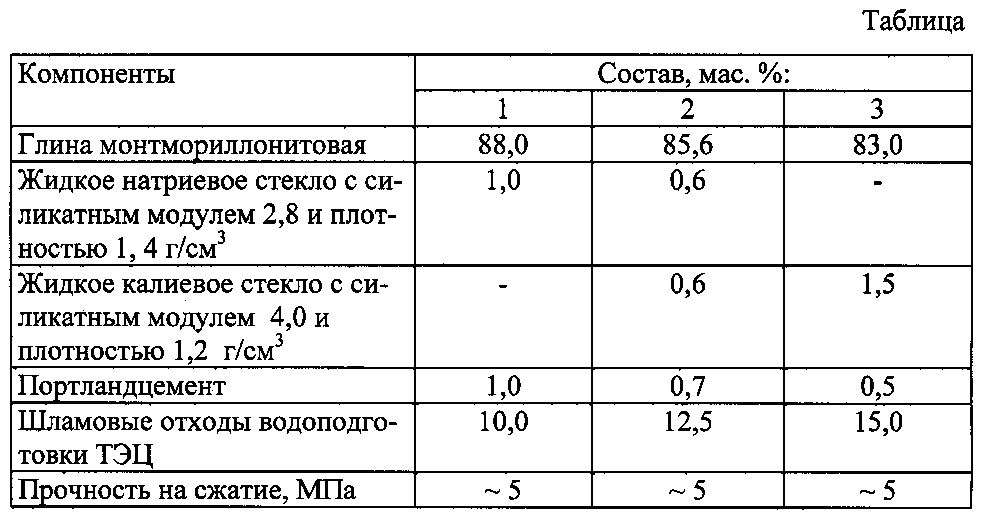 Песок в такую грунтовку не вводится Песок в такую грунтовку не вводится |
| Получения обмазочных составов для гидроизоляции колодцев | 1:1:1 с песком и ПЦ | Итоговая консистенция напоминает густую сметану, обмазка расходуется незамедлительно |
| То же, для улучшения огнеупорных качеств конструкций | 1,5:1,5:4 – для жидкого стекла, цемента и песка | Доля жидкости не превышает 25 % от общего объема добавки |
| Гидроизоляция бассейнов, стяжек полов, перекрытий | 10 % | На 10 объемных частей вводится 1 ЖС |
| Улучшение свойств обычного бетона | 3 % | Вводится в растворенном виде с общей дозой жидкости |
К общим правилам ввода относят:
- Предварительное разбавление водой с учетом заданных пропорций. Рекомендуемое соотношение вода/цемент при этом важно оставить неизменным.

- Тщательное и непрерывное перемешивание в процессе заливки концентрата. Для этих целей подходят дрель или смесители, все инструменты и емкости хорошо промываются по окончании приготовления. Чаще всего цемент смешивается со стеклом в уже затворенном виде: в готовую бетонную или песочную смесь вводятся растворенные силикаты, после чего все перемешивается еще раз.
- Разводить стекло следует холодной и чистой водой, без технических примесей. ПЦ и песок рекомендуется просеивать перед вводом.
- С учетом быстрого времени схватывания приготовленные составы расходуются без промедлений, все емкости и инструменты по окончании работ сразу же промываются водой.
- При необходимости гидроизоляции стяжки или стен грунты с такими добавками наносятся послойно, с просыханием каждого.
Блок: 2/2 | Кол-во символов: 3172
Источник: http://cemgid.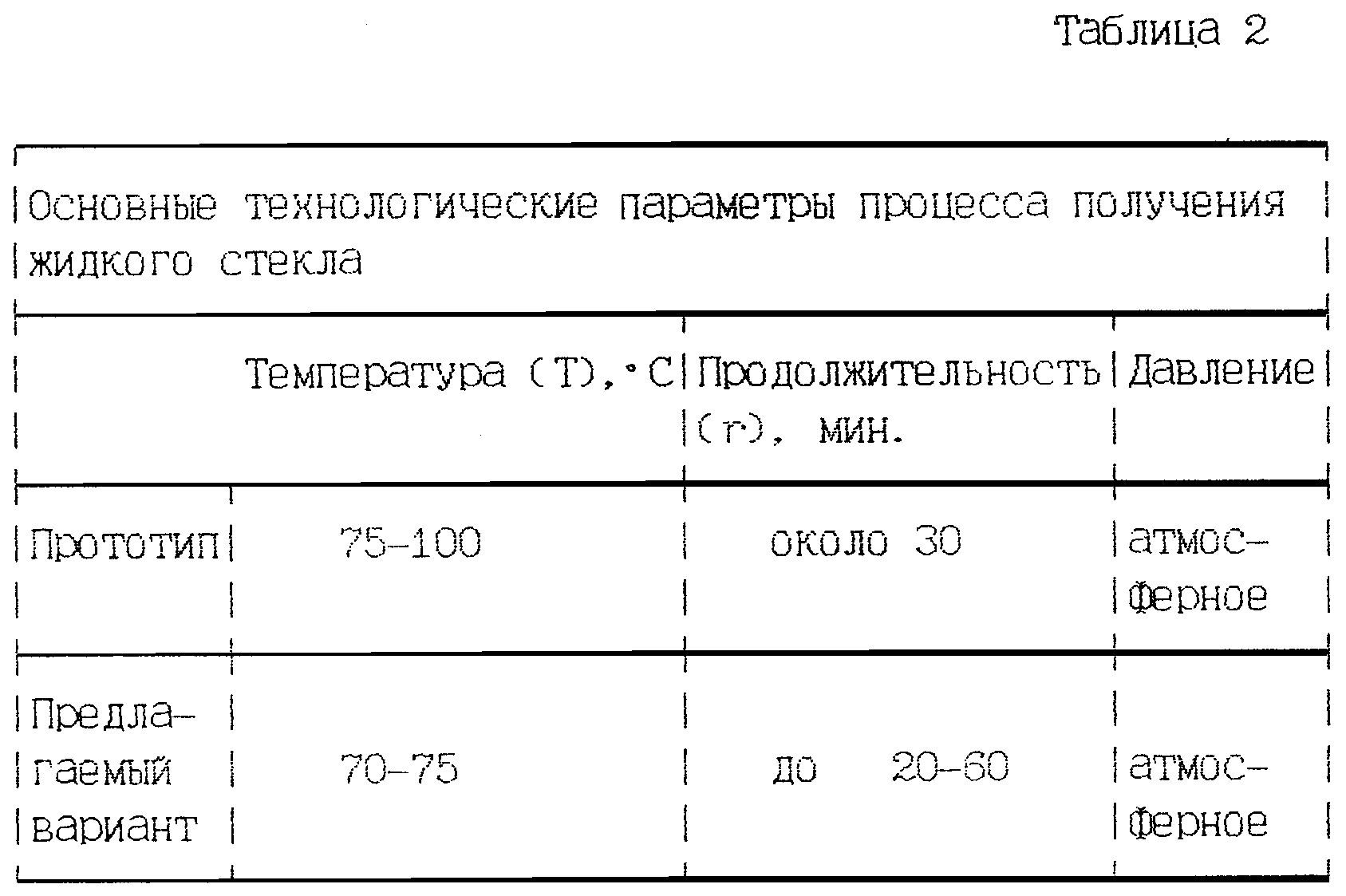 ru/soedinenie-zhidkogo-stekla-s-cementnym-rastvorom.html
ru/soedinenie-zhidkogo-stekla-s-cementnym-rastvorom.html
Плюсы и минусы использования жидкого стекла
Добавление силикатного стекла в раствор приводит к повышению его технических и эксплуатационных характеристик.
Среди основных плюсов:
- повышенная текучесть состава. Благодаря текучести продукта, он способен к проникновению в мельчайшие трещины для создания надёжной поверхностной защиты. Равномерное распределение состава происходит при нанесении как на бетон, так и дерево;
- формирует качественную, водонепроницаемую плёнку. Смесь жидкого стекла с цементом может наноситься любым удобным способом, не зависимо от метода использования, плёнка будет целостной и сплошной. Производителем разрешено наносить стекло и цемент с большим перерывом;
- небольшой расход. Этот раствор используют для закрытия трещины любого размера не зависимо от способа нанесения. Силикат с цементом можно смешивать хоть на этапе приготовления бетона, хоть для поверхностного покрытия в составе изоляционного материала;
Использование жидкого стекла при приготовлении строительных смесей на цементной основе является распространенной практикой
Средство является лидером по качеству и цене в своей сфере. В сравнении с другими материалами этот используется чаще из-за доступности и лёгкости нанесения, но у него есть недостатки.
К негативным сторонам относятся:
- ограниченное применение в строительных растворах. Помимо обработки бетона и дерева, его негде применять в строительстве;
- не используется как самостоятельное вещество. Применяется исключительно в совокупности с дополнительными веществами. Проблема кроется в хрупкости покрытия после застывания;
- сложность нанесения является относительно высокой, так как сделать раствор пригодным следует достаточно быстро. Важно иметь глубокие знания о тонкостях материала. Главная особенность – быстрое высыхание, состав готовят небольшими порциями, схватившийся материал становится непригодным к использованию. Важно понимать, сколько добавлять жидкого стекла в раствор, при превышении концентрации ухудшается качество бетона. Состав рекомендуется к использованию в течение 6 минут.
Использовать материал можно самостоятельно, а для улучшения результата можно внести пластификатор. Чтобы избежать перерасхода материала, лучше его приготовлять в малых количествах.
На практике — не рекомендуется вводить более 5 % жидкого силикатного стекла
Блок: 3/8 | Кол-во символов: 2302
Источник: https://pobetony.expert/poleznye-stati/zhidkoe-steklo-i-cement
Сферы использования
Жидкий силикат натрия целесообразно использовать в качестве добавки к растворам, которые применяются для отделки стен объектов снаружи. В этом случае нет прямого контакта с водой, поэтому со временем не произойдет вымывание добавки из смеси, но гидроизоляционные качества отделки стен улучшатся. В качестве строительной смеси для кладки использование жидкого стекла оправдано в тех случаях, в которых возводятся стены в погребах, смотровых канавах, в помещениях, которые нужно изолировать от влажной среды.
Нужно обязательно добавлять жидкое стекло в растворы, которые контактируют с кислотными средами, либо используются на высокотемпературных объектах. Данное условие вызвано способностью такой цементной смеси противостоять высоким температурам.
Важно помнить, что количество добавляемого силиката натрия обратно пропорционально времени застывания цементной смеси. Поэтому при проведении строительных или аварийных работ нужно учитывать пропорции, готовить раствор небольшими порциями и быстро их использовать.
Жидкое стекло добавляют в раствор следующим образом. Добавку смешивают с водой, для чего используют миксерную насадку на дрель, а затем затворяют цементный раствор.
Блок: 4/4 | Кол-во символов: 1222
Источник: http://o-cemente.info/izgotovlenie-betona/vliyanie-zhidkogo-stekla-na-svoystva-ce.html
Подготовка силикатного раствора – инструменты и расходные материалы
Эксперты советуют применять смеси, которые добавляются в жидкое стекло. Эти смеси служат тем, что при взаимодействии с воздухом они застывают и обеспечивают высокую прочность. Эти смеси имеют высокую стоимость. Чаще всего ремонтники покупают необходимые ингредиенты для приготовления подобных смесей своими руками. Для того чтобы это сделать понадобятся необходимые инструменты.
В наличии из инструментов необходимо иметь ведро, которое будет применяться для работных нужд. Также потребуется сверло для того, чтобы мешать раствор, поэтому на ней должна быть насадка шнекового вида. Также может потребоваться кисть.
Также понадобится цемент, песок, который должен быть мелко просеян, а также источник воды, например, колодец. Также, насколько нам известно, раствор очень быстро и прочно застывает, поэтому необходимо иметь специальную одежду.
Для получения нужного раствора требуется смешать воду и жидкое стекло. Пропорции воды и жидкого стекла зависит от того на какой вид работы будет использоваться раствор. В процессе смешивания советуется использовать холодную воду, поскольку это облегчит контролирование количества.
Блок: 4/6 | Кол-во символов: 1192
Источник: http://poznaibeton.ru/cement/zhidkoe-steklo-s-cementom.html
Пропорции компонентов при использовании жидкого стекла
Силикатный раствор, который продается в магазинах, имеет малое количество воды, что делает его излишне густым. Многие строители силикатный раствор приготавливают своими руками в домашних условиях. Приготовляя подобный раствор, строители смешивали обычные компоненты и купленные.
В процессе смешивания строители регулируют дозу добавляемой воды. Для каждого вида работы готовится раствор с определенными дозами продуктов. Например для приготовления раствора, который будет применен, в строительных работах должен содержать цемент, песок, и другие составы.
Главное для каждого вида работы правильно выбирать количество воды, ведь бывают случаи, когда нужен густой раствор. Но также бывают случаи, в которых он должен быть жидким, все зависит от вида работы.
Жидкое стекло и цемент. Пропорции
Для того чтобы произвести смешивания необходимо знать точные пропорции материала. Для приготовления раствора для поверхности из грунта необходимо использовать цемент и жидкое стекло. Для этого требуется вода и цемент их необходимо мешать и регулярно добавлять жидкое стекло.
Для приготовления раствора, который будет применяться как для наружных работ или защиты от огня применяют 4 части песка. Требуется, чтобы жидкое стекло занимало 1,5 часть. Цемент также должен занимать 1,5 части. Воду добавлять такого же количества, как и для приготовления раствора для грунтовой поверхности.
Также чтобы приготовить раствор для осуществления гидроизоляции необходимо иметь жидкое стекло количеством 1 литр, и раствор из цемента 8 литров. Для того чтобы сделать гидроизоляцию в подвале или колодце, то требуется такое же количество, но только нужно использовать еще и песок. Эксперты советуют перед нанесением раствора на поверхность намазать на нее жидкое стекло.
Для того чтобы приготовить раствор для наполнения трещин необходимо взять 3 доли песка, и по 1 доле цемента и песка. Все это требуется смешать с водой в количестве 25 % от веса силиката натрия. Затем в смесь требуется вливать жидкое стекло равномерно помешивая.
Пропорции. Цемент — песок — жидкое стекло
В применении песка для добавления в жидкое стекло необходимо знать нужные пропорции. Для каждого вида работы существуют определенные пропорции. Например, для приготовления смесь, которая будет использоваться, в целях защиты от огня требуется песок количеством в 1 кг.
Если раствор нужен для работы, которая заключается гидроизоляции колодца, то необходимо использовать жидкое стекло и песок равным количеством. После того как раствор был приготовлен его необходимо нанести на стены колодца.
Для приготовления раствора, который будет применяться для обмазки снаружи, и служить защитой от огня потребуется песок. Количество песка должен занимать 1 часть от всего раствора.
Блок: 5/6 | Кол-во символов: 2781
Источник: http://poznaibeton.ru/cement/zhidkoe-steklo-s-cementom.html
Технология приготовления раствора для гидроизоляции своими руками
Многие строители и ремонтники раствор для гидроизоляции приготавливают своими руками. Процедура приготовления этого раствора несложная и довольно выгодная.
Для приготовления раствора необходимо иметь:
- жидкое стекло,
- бетонный раствор,
- песчаный раствор,
- кварцевый песок.
Каждый из перечисленных материалов требует свои дозы:
- Количество жидкого стекла должно составлять 1,5 кг на 1 литр.
- Бетонный раствор должен составлять 2,5 кг на 1 литр.
- Песчаный раствор должен составлять 2,7 кг на 1 литр.
- Кварцевый раствор применяется для слежавшегося и рыхлого песка.
- Количество такого раствора для слежавшегося песка должно составлять 1,7 кг на 1 литр.
- Для рыхлого песка понадобится количество раствора 1,5 кг на 1 литр.
Смесь, которую получили, применяют как для изоляции полов, так и для стен. Эксперты советуют, что перед нанесением раствора на поверхность ее требуется залить слоем жидкого стекла. Заливка дополнительного слоя перед нанесением дает увеличение прочности гидроизоляции.
Красящие работы
Силикатные краски можно купить уже в готовом виде и применять сразу. Но также можно смешивать своими руками купив нужные компоненты. В случае если поверхность уже красили, то необходимо ее тщательно отчистить от старой краски.
За счет того, что в создание таких красок применяют силикат калия сама смесь и краска образуют прочную структуру. За счет того, что цветовая гамма имеет высокий уровень щелочности, многие пигменты разрушаются. Поэтому цветовая гамма имеет низкий уровень.
Наружные работы
Известно, что в наружную работу входит штукатурка стен. Штукатурка стен применяется для защиты от влаги. Для стен применяется водостойкая штукатурка.
Также преимуществом этой штукатурки является то, что она предотвращает трещины, которые появляются во время зимнего периода, ведь в это время стены замерзают, и оттаивают.
Также эту штукатурку можно приготовить своими руками для этого понадобится: песок, цемент и жидкое стекло.
Все эти материалы требуется добавлять по пропорции 1:2:5. Перед тем как наносить штукатурку можно нанести один слой силиката, как и при создании гидроизоляции.
Грунтование
Как правило, грунтование применяется для двух видов работы для простой стяжки и для кладки плитки. Для простого грунтования стяжки необходимо использовать жидкое стекло и цемент по равномерному количеству. Если на стяжки будет ложиться плитка, то требуется провести грунтование с раствором жидкого стекла.
Для подобных работ требуется водостойкий цемент. Также кроме водостойкого цемента можно применять силикатные растворы, и за счет них проводить гидроизоляцию швов.
Пропитка поверхностей
Проводить пропитку необходимо для защиты материала. Пропитка деревянных элементов жидким стеклом пользуется популярностью. Жидкое стекло способно предотвратить появления грибов и плесени на дереве. Также пропитка дерева жидким стеклом предает ему огнестойкость.
Также деревянный материал можно пропитывать, полностью опустив его в жидкое стекло, это придает прочность. Такая процедура возможна только для материалов малого габарита.
Как пользоваться жидким стеклом при ремонтных работах – замазке трещин, щелей и пустот?
Для замазки трещин и пустот жидкое стекло идеально подходит. Ведь жидкое стекло способно проникнуть в саму глубь трещин, образуя плотную гидроизоляцию.
Для смешивания требуется использовать цемент жидкое стекло и песок. Полученный раствор является очень густым, что не дает ему вытекать. Также за счет силиката раствор очень быстро застывает прочно схватывая.
Блок: 6/6 | Кол-во символов: 3538
Источник: http://poznaibeton.ru/cement/zhidkoe-steklo-s-cementom.html
Заключение
При расчёте фундамента калькулятором и определении количества облицовочного кирпича важно учитывать необходимость в бетоне, а также силикатах. Техника строительства бетона с водопроницаемостью приведёт к быстрому разрушению строения. Для постройки долговечного здания важно соблюдать концентрацию песка, цемента и жидкого стекла. Разведение бетона – очень серьезная процедура, её можно выполнять без предварительного согласования с заказчиком или государственными органами, но в строгом соответствии с инструкцией.
Originally posted 2018-05-23 10:03:35.
Блок: 8/8 | Кол-во символов: 565
Источник: https://pobetony.expert/poleznye-stati/zhidkoe-steklo-i-cement
Кол-во блоков: 15 | Общее кол-во символов: 28224
Количество использованных доноров: 7
Информация по каждому донору:
- http://o-cemente.info/izgotovlenie-betona/vliyanie-zhidkogo-stekla-na-svoystva-ce.html: использовано 2 блоков из 4, кол-во символов 3572 (13%)
- http://cemgid.ru/soedinenie-zhidkogo-stekla-s-cementnym-rastvorom.html: использовано 1 блоков из 2, кол-во символов 3172 (11%)
- https://zamesbetona.ru/podgotovka/skolko-zhidkogo-stekla-dobavljat-v-cementnyj-rastvor.html: использовано 2 блоков из 5, кол-во символов 3857 (14%)
- http://poznaibeton.ru/cement/zhidkoe-steklo-s-cementom.html: использовано 4 блоков из 6, кол-во символов 9209 (33%)
- https://pobetony.expert/poleznye-stati/zhidkoe-steklo-i-cement: использовано 3 блоков из 8, кол-во символов 3265 (12%)
- http://stroitel-list.ru/cement/v-kakix-proporciyax-smeshivayutsya-zhidkoe-steklo-i-cement.html: использовано 1 блоков из 2, кол-во символов 4639 (16%)
- https://pobetony.ru/raschet/zhidkoe-steklo-cement-proporcii/: использовано 1 блоков из 4, кол-во символов 510 (2%)
Поделитесь в соц.сетях: | Оцените статью: Загрузка… |
Добавить в бетон жидкое стекло пропорции применение
Добавить в бетон жидкое стекло
Как правило одной из причин, по которой добавляют в бетон жидкое стекло — это его незначительная цена при возможном действии его свойств, которые в свою очередь очень сильно улучшают весь состав раствора.
Добавление жидкого стекла сильно рекомендуется, когда то или иное бетонное сооружение будет иметь воздействие от влаги.
Жидкое стекло применяют для гидроизоляции бетона. Состав жидкого стекла обладает специальными антибактериальными свойствами, из-за этого полученный раствор с жидким стеклом в ходе работы не будет подвергаться какому-либо действию плесени.
Такая смесь, как цемент с жидким стеклом часто используется при постройке печей.
Чтобы приготовить эту смесь, берут одну часть цемента и три части песка, к которым добавляется силикатный клей в количестве, равном примерно один к пяти от всей массы цемента.
Если смешать цемент и песок в пропорциях один к двум с половиной и добавить к ним примерно пятнадцать процентов жидкого стекла, после этого добавить воду, то в результате получится хорошая водостойкая штукатурка.
Именно для таких случаев многие из хороших строителей добавляют в бетон жидкое стекло.
Жидкое стекло в бетон пропорции
В настоящее время имеется большая область применения такого материала, как жидкое стекло.
Когда такое вещество добавляют в цемент, его общая вес не должен превышать двадцати пяти процентов.
Если разобраться чуть по глубже, то использование жидкого стекла в стройке имеет более узкое направление.
Жидкое стекло в бетон пропорции:
Для использования в грунтовке — это вещество берется пропорцией одни к одному с раствором из цемента.
А если использовать жидкое стекло, как специальную добавку в бетон, то он должен занять двадцать пять процентов от общего веса.
Перед началом применения жидкого стекла, нужно приготовить водный раствор . Для этого нужно разбавить водой стекло в пропорции один к двум.
Такой материал используют, как гидроизоляцию для помещений. Чтобы начать такое применение, нужно разбавить один литр жидкого стекла с десяти литровым бетонным раствором.
Жидким стеклом можно замазать стыки у труб водопровода и использовать такой раствор, чтобы удалить старую краску.
Еще можно сделать из стекла универсальный клей, который в свою очередь будет предназначаться для соединения разных строительных материалов.
Жидкое стекло применение в бетоне
Одной из самых главных причин добавления жидкого стекла в бетон является его очень маленькая ценовая категория и отличные свойства, с помощью которых сильно улучшается весь состав раствора.
Если конструкция из бетона имеет сильное воздействие какой-нибудь влаги, то практически всегда советуют добавить в нее жидкое стекло.
Также жидкое стекло используют для гидроизоляции в бетон. Благодаря тому, что состав имеет антибактериальные свойства, раствор с жидким стеклом в применении не будет подвергаться воздействию плесени и грибка.
Еще жидкое стекло применяют в добавление с цементом для кладки различных печей и каминов.
При смешивании цемента и песка в пропорции один к двум с половиной и если добавить к ним около пятнадцати процентов жидкого стекла, а после еще добавить воду, то получается хорошая водостойкая штукатурка.
Как правило, когда добавляют такую смесь, как жидкое стекло в бетон, то он застывает достаточно быстро.
Делая вывод, можно считать применение жидкого стекла в бетоне очень частым и практически незаменимым.
Гидроизоляция бетона жидким стеклом
Многие из опытных строителей для уменьшения впитывания влаги и повышает стойкость материала для стирания, применяют жидкое стекло.
Этот материал благодаря своим свойствам можно использовать, как гидроизоляцию. Можно замазывать подвалы и чердаки, чтобы влага не попадала в них.
Такое действие позволит обеспечить защитой помещение от сырости, грибка и плесени.
Обладая специальной структурой, этот материал обеспечивает защиту от влаги и защищает весь материал от разрушения. Гидроизоляция бетона жидким стеклом, стала теперь обыденным делом для настоящих профессионалов.
Также такой материал, как жидкое стекло добавляют в цементные растворы. Такая добавка делает вашу смесь более эластичной и расширяет все свойства.
Таким образом, можно сделать вывод, что жидкое стекло это заменитель многих пластификаторов.
При смешивание, оно заменяет пластификатор гидроизоляции, заменяет пластификатор, который делает смесь эластичней, также заменяет пластификатор быстрого затвердения.
Пропитка бетона жидким стеклом
Пропитка бетона жидким стеклом очень сильно набирает обороты в строительной сфере.
Расскажем для чего служит обработка бетона этим веществом, как жидкое стекло:
Во-первых оно очень хорошо применяется для обработки натурального или искусственного камня, бетонной или оштукатуренной поверхности.
Во-вторых хорошо применяется для резкого повышения антисептических свойств.
В третьих служит для защиты от влаги, от воздействия воды.
Для того чтобы можно было обработать бетонную или оштукатуренную поверхности таким раствором, как жидкое стекло, нужно будет взять раствор жидкого стекла с водой по пропорции один к пяти.
А если используется фтористый силикат, тогда нужно делать пропорцию один к одному.
Вообще, пропитка бетона жидким стелом стала очень актуальна в последнее время.
Такая пропитка может наноситься простой кисточкой или краскопультом, применение будет зависеть от того, как обрабатываемая поверхность может впитывать раствор.
А также вы можете посмотреть видео решение проблемы рыхлой стяжки — жидкое стекло
Подобрано для вас:
Жидкое стекло для гидроизоляции: характеристика, достоинства, применение
Среди большого количества вариантов для совершения гидроизоляции, жидкое стекло выделяется множеством преимуществ. Об особенностях, применении и характеристике этого материала рассмотрим далее.
Оглавление:
- Общее понятие и преимущества жидкого стекла
- Сфера использования и разновидности жидкого стекла
- Рекомендации по работе с жидким стеклом
- Жидкое стекло — инструкция по работе и применение
- Жидкое стекло для гидроизоляции — нюансы в применении
- Рекомендации по выбору и покупке жидкого стекла
- Советы по приготовлению растворов на основе жидкого стекла
Общее понятие и преимущества жидкого стекла
Под понятием жидкое стекло подразумевают раствор на основе воды и натриевых или калиевых силикатов. Он имеет вязкую структуру, и поэтому отлично справляется с выполнением работ, связанных с гидроизоляцией.
Если рассматривать состав жидкого стекла, то в нем легко видны небольшие кристаллы, которые после того, как наносятся на поверхность увеличиваются, заполняя при этом мелкие трещины. Именно благодаря такой структуре, жидкое стекло характеризуется водоотталкивающим и воздухонепроницаемым эффектом. Жидкое стекло используется в разнообразных сферах, благодаря своей экологичности и безвредности.
Если говорить о принципе действия жидкого стекла, то оно имеет клеящуюся способность. Это проявляется из-за того, что в молекулы твердого материала, которые не имеют между собой тесных связей, попадают молекулы жидкого стекла, которые проникают во внутреннюю часть твердых молекул и таким образом получается их адгезия.
Жидкое стекло напоминает резину, которая находится в жидком состоянии. После ее нанесения поверхность становится водо- воздухонепроницаемой. В состав жидкого стекла входит кальциевый или натриевый силикат, в который добавили соду или кварцевый песок. При производстве жидкого стекла происходит его дробление, обжигание и вторичное дробление в порошковую массу.
Смесь жидкого стекла имеет свойства:
- гидрофобизатора — то есть водоотталкивателя;
- антисептика — не допускает образование бактерий;
- антистатика — отсутствует электризация;
- отвердителя — материал, на который наносится жидкое стекло, становится прочным;
- кислозащитителя;
- пожаробезопасного материала устойчивого к возгоранию.
Данный материал обладает большим количеством преимуществ, изучая о жидком стекле отзывы, выделяют такие его достоинства:
1. Жидкое стекло является очень жидкой адгезией, которая с легкостью из-за текучего состояния способна проникнуть в самые маленькие поры и трещинки. Также оно характеризуется сильным сцеплением с поверхностью и легко покрывает как бетонные, так и деревянные основания.
2. Создание жидкой водонепроницаемой пленки является еще одним преимуществом данного материала. Независимо от того, как производится нанесение жидкого стекла, получается целая и влагоустойчивая поверхность.
3. Небольшой расход жидкого стекла также является его достоинством. Особенно в том случае, когда оно добавляется в раствор цемента, в качестве гидроизоляции проникающего типа.
4. Если сравнивать стоимость жидкого стекла с другими гидроизоляционными материалами, то оно успешно у них выигрывает, так как имеет наиболее доступную стоимость среди альтернативных вариантов.
5. Гидроизоляция жидким стеклом имеет срок эксплуатации, который составляет 5 лет. Данный материал постепенно саморазрушается, но если покрыть гидроизоляцию защитным слоем краски, она прослужит намного дольше.
6. Является единственным изолятором, который позволяет проводить работы даже в условиях с высокой влажностью.
Несмотря на большое количество преимуществ жидкого стекла, имеется и ряд его недостатков:
1. Имеет ограниченную сферу использования — применяется в качестве гидроизоляции поверхностей бетонного или деревянного типа. Запрещается применять раствор жидкого стекла для гидроизоляции кирпичных поверхностей, из-за возможного их разрушения.
2. Пленка, которую образует жидкое стекло, достаточно хрупкая, поэтому его нужно использовать в качестве комбинации нескольких видов гидроизоляции.
3. Сложность нанесения — материал очень быстро высыхает и образует пленку, поэтому требуются навыки работы, чтобы сделать гидроизоляцию качественно.
Жидкое стекло фото:
Сфера использования и разновидности жидкого стекла
Как говорилось выше, жидкое стекло подходит не для всех материалов, но при этом сфера его применения довольно широкая. Жидкое стекло используют в таких случаях:
1. Если добавить жидкое стекло в цементный раствор, то получится надежное покрытие, защищенное от влаги и отрицательного влияния грунтовых вод, в том случае, если раствор применяется для заливки фундамента.
2. Жидкое стекло применяется для гидроизоляции бассейнов или искусственных прудов.
3. Используется в качестве клея, для склеивания различного рода строительных материалов.
4. Применяется для производства растворов с огнеупорными или кислоустойчивыми характеристиками.
5. Если в доме возникает проблема появления плесени или грибка, следует нанести несколько слоев жидкого стекла на предварительно очищенные пораженные участки.
6. Применяют раствор жидкого стекла в качестве клея, для ремонта бумажных, картонных, деревянных или фарфоровых изделий.
7. Чтобы герметизировать малоподвжные швы или оштукатурить бассейн отлично подойдет раствор цемента и жидкого стекла. Но, учтите, что работать с таким раствором нужно быстро, так как через некоторое время он густеет и становится непригодным.
8. Если планируется постройка дома на слабых грунтах, которые через несколько лет дадут усадку, то раствор цемента с жидким стеклом применяют для инъекций, которые вводят в верхние слои грунта.
Если рассматривать сферу использования жидкого стекла в качестве гидроизоляции, то выделим такие варианты:
1. Жидкое стекло используется в качестве обмазочной гидроизоляции. Перед установкой рулонной гидроизоляции, на поверхность наносят несколько слоев жидкого стекла. Раствор отлично заполняет все трещины и поры бетонной поверхности.
2. Раствор жидкого стекла с цементом применяют для того, чтобы ликвидировать серьезные течи или в качестве гидроизоляции швов фундамента сборного типа.
3. Жидкое стекло входит в состав бетона, оно улучшает его монолитность и обеспечивает гидроизоляцию.
Распространены два вида жидкого стекла:
- калиевое,
- натриевое.
Первый вариант имеет хорошую клейкость, применяется при гидроизоляции фундаментных частей здания. Входит в состав пропиток антисептического действия. Отлично взаимодействует с составами на основе минералов.
Второй вид является добавкой из металла и способствует улучшению устойчивых характеристик стекла. Устойчиво перед кислотами. Не имеет характерного для стекла блеска, поэтому применяется в качестве окрашивания поверхностей.
Рекомендации по работе с жидким стеклом
Если жидкое стекло будет наноситься на поверхность, то предварительно его разбавляют водой, в соотношении на 100 г материала, 200 грамм воды. В таком случае, на один квадратный метр потребуется не более 300 г раствора.
Гидроизоляция с помощью жидкого стекла используется на тех стенах, на которых выветрилась штукатурка или на бетонные стены с неровностями. Использование жидкого стекла укрепит и выровняет поверхность, а также создаст защитный антисептический слой.
Есть несколько методов нанесения данного материала. Перед тем, как примененять жидкое стекло следует обезжирить поверхность, очистить и максимально выровнять. Если требуется пропитка бетона на небольшой глубине до трех миллиметров, то используют краскопульт или кисточку. При необходимости в глубокой пропитке, которая превышает два сантиметра, нужно нанести минимум три слоя раствора.
Если жидкое стекло используется для гидроизоляции пола или бетонной стяжки, то один литр материала, добавляется в 10 л бетонного раствора. Также жидкое стекло является отличной антикоррозийной пропиткой, им обрабатывают металлические конструкции. Чтобы обеспечить защиту бассейна от утечки воды, также применяется нанесение раствора жидкого стекла. Жидкое стекло входит в состав красок огнеупорного назначения.
Жидкое стекло — инструкция по работе и применение
Для приготовления раствора из бетона и жидкого стекла пропорции составляют один к десяти. Эту смесь применяют для гидроизоляции колодца, бассейна, ванной комнаты, подвала и других конструкций из бетона или железобетона.
Нанесения материала, достаточно легкий процесс, во время которого на поверхности образуется защитный слой, который является барьером для проникновения влаги.
Не следует обрабатывать таким растровом фасад здания, если планируется его дальнейшая покраска, так как адгезия краски и стены будет низкой, и краска практически не ляжет на поверхность.
В процессе работы с жидким стеклом рекомендуется использовать специальную одежду. Чтобы сделать русскую печь традиционного типа применяют раствор на основе цемента и жидкого стекла. Соотношение компонентов песок: цемент: силикатный клей — 3:1:0,2. В результате получится смесь, напоминающая тесто, очень удобная в работе и имеет хорошие эксплуатационные характеристики в качестве материала для сооружения печи.
Использование силикатного клея, в который добавлено жидкое стекло, очень популярно среди строителей. Он применяется в целях приклеивания плитки из поливинилхлорида или линолеума. Жидким стеклом замазывают водопроводные трубы, чтобы избежать утечки воды и заделать стыки. Чтобы изготовить защитную негорючую ткань, также применяется жидкое стекло в качестве пропитки.
Жидкое стекло — универсальный материал, который применяется даже в садоводстве. При появлении небольших ран на деревьях или кустах, их замазывают жидким стеклом. Оно является отличным антисептиком, и предотвращает развитие вредоносных бактерий.
Жидкое стекло для гидроизоляции — нюансы в применении
Перед тем, как наносить жидкое стекло на поверхность, следует ее обязательно очистить от пыли и грязи.
Затем выполните ряд действий:
1. Кисточкой или валиком нанесите жидкое стекло на поверхность.
2. Подождите 30 минут и нанесите еще один слой. Старайтесь делать это равномерно не допуская появления пропусков.
3. Следующий этап — подготовка защитного слоя. Сделайте обычный раствор на основе цемента и песка. Добавьте в него жидкое стекло, по пропорции один к одному.
4. Перемешайте и в очень быстром темпе нанесите на поверхность. Второй раз такой раствор наносить не стоит, так как функции жидкого стекла не будут выполняться.
5. Производите смешивание постепенно, наносите раствор на поверхности при помощи цементного шпателя стандартным слоем.
И помните, перед тем как использовать жидкое стекло, следует осмотреть его на предмет чистоты, посторонних предметов или комочков. Срок хранения жидкого стекла достаточно длительный, а температурный диапазон широкий. Поэтому даже если оно хранится на улице в зимнее время года, на его качествах это никак не отразится.
Рассмотрим нанесение жидкого стекла на фундамент:
- произведите очистку поверхности от различного рода загрязнений с помощью наждачной бумаги;
- для равномерного нанесения раствора воспользуйтесь валиком;
- нанесите второй, и по желанию третий слои, по истечению 30 минут;
- утеплите фундамент минеральной ватой или пенопластом.
Рекомендации по выбору и покупке жидкого стекла
Чтобы купить жидкое стекло, обратитесь в любой строительный магазин или рынок. Среди большого количества производителей жидкого стекла, практически не существует разницы в его составе. Поэтому какому производителю отдать предпочтение, личное дело каждого. Но, в принципе, даже самый дешевый материал, имеет такие самые характеристики, как и дорогой.
Жидкое стекло цена составляет от 2 $ за 10 л. Как видите материал, действительно не дорогой, но в то же время многофункциональный.
Если делать выбор между жидким стеклом натриевого или калиевого типа, то каждый вариант имеет свои преимущества и недостатки.
Калиево жидкое стекло используется для фундамента, так как является более вязким, а натриево — для гидроизоляции других объектов строительного назначения.
Советы по приготовлению растворов на основе жидкого стекла
1. Есть вариант приготовления грунтовки на основе жидкого стекла. Не рекомендуется обрабатывать стены чистым раствором жидкого стекла. Благодаря антисептическим свойствам жидкое стекло отлично справляется с функцией грунтования, предотвращения образования плесени и грибка и повышения адгезии.
Чтобы приготовить грунтовку на основе жидкого стекла необходимо наличие:
- цемента,
- жидкого стекла,
- воды.
Количество цемента и жидкого стекла одинаково, а вода должна сделать смесь жидкой, пригодной для нанесения на стену с помощью валика. Сначала цемент смешивается с водой, а затем добавляют жидкое стекло. Для этого воспользуйтесь дрелью или строительным миксером. Рекомендуется использовать раствор в течении получаса, если он затвердел — добавьте немного воды.
2. Для приготовления гидроизоляционного или огнеустойчивого раствора следует взять немного просеянного песка. Одинаковые части воды, цемента, песка и жидкого стекла смешивается. Данная смесь отлично справляется с гидроизоляцией колодцев.
3. Антисептические растворы помогают избежать появления микроорганизмов или бактерий. Его приготовление — простой процесс. Для этого смешайте жидкое стекло с водой один к одному и покройте таким раствором, например, деревянную поверхность. Это намного дешевле традиционных влагоустойчивых пропиток, но не менее эффективнее.
4. Чтобы изготовить пропитку из жидкого стекла, которой покрывают стены, потолки или пол, следует в одном литре воды развести четыреста грамм жидкого стекла.
Жидкое стекло видео:
Жидкое стекло для бетона: приготовление, пропорции, советы
С целью придания водоизоляционных качеств застывающей массе и для улучшения ее прочности, используется жидкое стекло для бетона. Также состав ускоряет процесс застывания цементной массы. Перед началом работы по укладке бетона с использованием силиката, надо изучить принципы правильного приготовления такого раствора.
Для чего в бетон добавляют жидкое стекло
Строительная смесь изготавливается путем перемешивания пропорций песка, щебня, цемента. Он получается прочный, но бывает так, что требуется добавление пластификаторов. Таковым выступает жидкое стекло (ЖС). На раствор оказываются следующие воздействия:
- Повышается влагоустойчивость. Это важно при формировании конструкций, находящихся в постоянном контакте с водой либо во влажных помещениях.
- Процесс застывания сокращается во времени, но требуется температура окружающего пространства в пределах 20 градусов.
- Раствор приобретает гидроизоляционные свойства.
- Приобретенная антибактериальность препятствует размножению бактерий, плесени.
- Увеличивается прочность на истирание.
- Смесь получается эластичной, что облегчает нанесение.
- Повышается устойчивость к повышенным температурам. Раствор с ЖС способен выдержать температуру в 1400 градусов, при этом обычный состав противостоит 200 градусам. И после длительного нагрева способен разрушиться. Эти нюансы важны при кладке печей и каминов.
Читайте также: Как выбрать жидкое стекло для дерева?
Как правильно приготовить бетонный раствор с жидким стеклом
Если замешивание выполняется первый раз в домашних условиях, то в таком случае необходимо подробное изучение пропорций составляющих. Несоблюдение повлечет за собой непрочность конструкции.
Инструменты для работы
Перед началом работы подготавливается инструмент и материалы, которые понадобятся в процессе замешивания раствора:
- Жидкое стекло.
- Песок (требуется просеять), цемент, вода.
- Емкость для замеса.
- Дрель с насадкой для равномерного размешивания.
- Средства личной защиты.
Пропорции жидкого стекла
Рекомендовано использовать для замеса соотношение бетона с жидким стеклом 1:10. Так как добавление ЖС в бетон влияет на время застывания.
Читайте также: Какой клей выбрать для монтажа фанеры на бетонную стяжку?
Применяемые пропорции:
- Доля клея в бетонной смеси 2% – начальное схватывание наступит через 45 минут, конечное – сутки.
- 5% силиката натрия в растворе – начальное схватывание через полчаса, конечное – 16 часов.
- 8% силиката натрия в растворе – начальное схватывание через 15 мин, конечное – 8 часов.
- 10% силиката натрия в растворе – начальное схватывание через 5 мин, конечное – 4 часа.
Данные пропорции применимы для цемента марок М300, М400.
Повышенный процент содержания силиката приведет не к улучшению качественного состава, а поспособствует разрушению конструкции в ходе эксплуатации.
Правильно готовится смесь при следующем способе с применением строительного миксера:
- Одно ведро воды, очищенной от примесей и добавок.
- Вылить стакан силиката, тщательно перемешать.
- Вылить массу в емкость большего объема.
- Добавить состав цемента с песком. Постоянно производить перемешивание миксером (либо дрелью с наконечником).
- Смесь готова.
Подобное соответствие используемых материалов и порционное замешивание позволяет достичь значительного качества и полной гидроизоляции конструкции.
Правила применения
Кроме соблюдения пропорций при замесе, требуется знать необходимые требования применения и изучение инструкции по применению жидкого стекла. Правила такие:
- Недопустимо дополнение силикатом натрия готового замеса. Для начала приготавливается сухая смесь цемента с песком, затем она разводится постепенным прибавлением раствора воды с силикатом. Соблюдается постоянное размешивание.
- Регулярно выполнять руководство, придерживаться пропорций элементов. Например, для фундамента достаточно 3% содержания клеящего состава, при иных применениях процент повышается до 10.
- При быстром застывании раствора в емкости, допускается добавление малого количества чистой воды. Если не хватает времени на использование готовой смеси, то следует прибегнуть к замесу малого количества пропорций. Поэтому при применении ЖС, не следует использовать бетономешалку, так как по ней смесь растечется и быстро застынет.
Рекомендуем посмотреть видео-инструкцию:
Техника безопасности
Применение такого средства для приготовления замеса не доставляет особых хлопот, но такая работа требует соблюдения техники безопасности.
Силикат натрия не содержит токсических соединений и безвреден для организма, но при попадании на открытые участки кожного покрова приводит к раздражению. Также при разбрызгивании средство попадает на слизистую оболочку глаза либо верхних дыхательных путей, что тоже приводит к их раздражению, в худших случаях, к ожогу.
Поэтому работу следует проводить в перчатках, халате, с маской на лице. Такие средства защиты помогут предотвратить не желаемые последствия для организма.
Если попадание произошло, то следует немедленно промыть слизистые и покров большим количеством воды. Кожные покровы после промывки смазываются кремом либо мазью без содержания активных компонентов. При необходимости обратиться к врачу.
В заключение
Зная, как правильно применять жидкое стекло при приготовлении бетонного состава, возможно, провести качественную работу по возведению прочной, влагостойкой конструкции.
Использовали материал при работе? Оставьте комментарий и поделитесь статьей в соцсетях.
Жидкое стекло и мыло в бетон: пропорции
Добавляют жидкое стекло в бетон для увеличения гидроизоляционных свойств конструкции. Однако применение этого продукта не ограничено строительной сферой.
При приготовлении бетонной смеси очень важно соблюдать рекомендованные пропорции основных компонентов и специальных добавок.
Жидкое стекло — это экологически чистая антисептическая добавка, состоящая из силикатов натрия и калия. Это бесцветное вещество, имеющее особый специфический запах. По физическим характеристикам похоже на канцелярский клей. Благодаря своему составу применяется во многих областях промышленности: литейной, мыльной, бумажной, текстильной. Без жидкого стекла практически невозможно изготовить мыло, бумагу и различные виды клея. При добавлении жидкого стекла в клей получается универсальное клеящее вещество для металла, дерева или пластика. В быту жидкое стекло или вассерглас может применяться довольно широко. С его помощью можно склеивать декоративную посуду или детали интерьера, замазать трещины и избавиться от мелких дефектов. Это универсальное вещество широко применяется в строительстве, например, для гидроизоляции какой-либо конструкции, при строительно-ремонтных работах. Так, добавление стекла в жидкий бетон улучшает качество последнего, а при производстве стройматериалов вещество на основе раствора силикатов улучшает их физические характеристики.
Повышенная влагоустойчивость бетона достигается благодаря добавления в смесь жидкого стекла.
Бетон с жидким стеклом применяется обычно, только когда требуется повышенная влагоустойчивость всей конструкции. Если ввести жидкое стекло в бетон, можно добиться от готового материала следующих положительных качеств:
- дополнительные влагозащитные свойства поверхности покрытия;
- антибактериальные свойства — в процессе эксплуатации на поверхности не появляются плесень и грибок;
- усиленная огнеупорность;
- глубокая гидроизоляция всей смеси;
- укрепление связи между компонентами смеси.
Жидкий бетон после добавления вассергласа очень быстро застывает, это не всегда положительное качество, поэтому опытные строители рекомендуют делать смеси в небольших количествах и постоянно добавлять воду.
Пропорции жидкого стекла в бетоне
Перед тем как ввести жидкое стекло в бетон, необходимо приготовить водный раствор на его основе. Жидкое стекло разбавляем водой в пропорциях 1/2 и тщательно перемешиваем, затем полученную смесь соединяем с цементным раствором. Связующее вещество в виде жидкого клея должно составлять не менее 25% от общей массы бетона. Применение раствора силикатов оправдано его экономией и свойствами, благодаря которым это вещество становится незаменимым при повышенных требованиях к гидроизоляции строения. Низкая стоимость жидкого стекла позволяет использовать его при больших объемах строительства. Однако при использовании раствора жидкого стекла следует знать о том, что он изменяет физические характеристики бетонной смеси. После добавления силикатного клея в бетонную смесь исключается любая обработка бетона после застывания, в том числе и покраска. В жидком стекле есть вещества, которые не дадут обычной краске лечь на поверхность бетона гладко и ровно.
Жидкое стекло для приготовления бетона часто используется как добавка при штукатурных и шпаклевочных работах.
Жидкое стекло также используется в грунтовке, в таком случае пропорции смеси должны составлять один к одному с раствором из цемента. Силикатный клей на пару с цементом применяется при кладке каминов и печей. Для приготовления такого раствора необходимо четко соблюсти пропорции. На 1 кг цемента берем 3 кг песка, добавляем силикатный раствор в количестве 1/5 от общей массы цемента, после чего добавляем воду и замешиваем массу.
Жидкое стекло для бетона очень часто используют как добавку при различных штукатурных и шпаклевочных работах. Если немного изменить процент вхождения ингредиентов в смесь, например, взяв цемент и песок из расчета 1 к 2,5, затем добавить 15% силиката, налить воды и хорошенько перемешать, то получится превосходная водозащитная штукатурка.
Вернуться к оглавлению
Применение жидкого стекла
Добавление силикатного клея при отделочных работах придает обработанной поверхности повышенную стойкость к высоким температурам и коррозии.
С помощью жидкого стекла для бетона проводятся работы, улучшающие гидроизоляционные характеристики подвалов, колодцев и различного рода перекрытий.
Вассерглас очень часто применяют в строительстве как связующее вещество, позволяя добиваться от растворов, таких качеств, как прочность, долговечность, огнеупорность, стойкость к воздействию атмосферных факторов. Используется при изготовлении особо стойких жидких покрытий. К примеру, краски, в состав которой входит раствор силикатов, обеспечивают огнеупорность окрашенной поверхности. Также, благодаря отсутствию вредных для человеческого организма составляющих, такие покрытия рекомендуются для использования в помещениях с большой проходимостью людей. Грунтовка на основе раствора силикатов натрия обеспечивает защиту от стрессовых атмосферных воздействий, защищает от осадков и влаги. Этот универсальный материал, очень часто используется в качестве дополнительного покрытия кирпичных, бетонных и деревянных поверхностей. Жидкое стекло прекрасно хранится. Если емкость, в которой находится вассерглас надежно герметизировать и лишить доступа воздуха, оно не теряет своих свойств в течение года.
Вернуться к оглавлению
Правила безопасности при использовании жидкого стекла для бетона
При использовании этого универсального вещества просто необходимо соблюдать правила безопасности. Старайтесь избегать попадания жидкости на открытую поверхность кожи. Производите работу с силикатными растворами только в защитных перчатках. Вассерглас ни в каком виде нельзя употреблять в пищу. Посуду, в которой производились работы с жидким стеклом, нельзя использовать для приготовления пищи для людей или животных.
После работы ее нужно замочить в большом объеме холодной воды на срок от 5 часов. После посуду следует тщательно вымыть с использованием моющего средства. Затем вновь замочить в воде. Эту процедуру следует повторить не менее 3 раз. При попадании раствора силикатов в глаза следует немедленно прекратить работу и промыть пораженный орган большим количеством воды. После этого пострадавший должен быть немедленно доставлен в больницу для оказания квалифицированной помощи.
Стакан для воды | химическое соединение
жидкое стекло , также называемое силикатом натрия или растворимым стеклом , соединение, содержащее оксид натрия (Na 2 O) и кремнезем (диоксид кремния, SiO 2 ), которое образует стеклообразное твердое вещество с очень полезное свойство растворяться в воде. Жидкое стекло продается в виде твердых комков, порошков или прозрачной сиропообразной жидкости. Он используется в качестве удобного источника натрия для многих промышленных продуктов, в качестве добавки в моющих средствах для стирки, в качестве связующего и адгезива, в качестве флокулянта на водоочистных установках и во многих других областях.
Жидкое стекло производится с 19 века, и основные принципы создания «силиката соды» с тех пор не изменились. Обычно его получают путем обжига различных количеств кальцинированной соды (карбонат натрия, Na 2 CO 3 ) и кварцевого песка (вездесущий источник SiO 2 ) в печи при температурах от 1000 до 1400 ° C ( приблизительно 1800 и 2500 ° F), процесс, который выделяет диоксид углерода (CO 2 ) и производит силикат натрия (Na 2 SiO 3 ; обычно представлен двумя его составляющими, Na 2 O и SiO . 2 ):
Na 2 CO 3 + SiO 2 → Na 2 O ∙ SiO 2 + CO 2
Подробнее по теме
промышленное стекло: стекло силикатно-натриевое
Во введении к этой статье упоминается В.Классическое определение стекла Х. Захариасеном как трехмерной сети атомов, образующих …
В результате этого обжига образуются плавленые стекловидные куски, называемые стеклобоем, которые можно охлаждать и продавать в таком виде или измельчать и продавать в виде порошков. Кусковое или молотое жидкое стекло, в свою очередь, можно подавать в реакторы под давлением для растворения в горячей воде. Раствор охлаждают до вязкой жидкости и продают в контейнерах размером от маленьких банок до больших бочек или резервуаров.
Жидкий силикат натрия можно также приготовить непосредственно путем растворения кварцевого песка под давлением в нагретом водном растворе каустической соды (гидроксид натрия, NaOH):
2NaOH + SiO 2 → Na 2 O ∙ SiO 2 + H 2 O
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Подпишитесь сейчас
При любом способе производства, чем выше отношение SiO 2 к Na 2 O и чем выше концентрация обоих ингредиентов, тем более вязкий раствор. Вязкость — это продукт образования силикатных полимеров, при этом атомы кремния (Si) и кислорода (O) связаны ковалентными связями в большие отрицательно заряженные цепные или кольцевые структуры, которые включают в себя положительно заряженные ионы натрия, а также молекулы воды. Высоковязкие растворы можно сушить распылением с образованием стеклянных шариков гидратированного силиката натрия.Гранулы могут быть упакованы для продажи коммерческим потребителям так же, как измельченный стеклобой, но они растворяются быстрее, чем безводная форма жидкого стекла.
Эти свойства делают гидратированные силикаты натрия идеальными для использования в одном из наиболее распространенных потребительских товаров: порошковых средствах для стирки и посудомоечных машин. Растворенное жидкое стекло является щелочным от умеренного до сильного, и в моющих средствах это свойство способствует удалению жиров и масел, нейтрализации кислот и расщеплению крахмала и белков.Это же свойство делает состав полезным для удаления краски с макулатуры и для отбеливания бумажной массы.
Небольшие количества растворенного жидкого стекла используются при очистке городского водоснабжения, а также сточных вод, где оно адсорбирует ионы металлов и способствует образованию рыхлых скоплений частиц, называемых хлопьями, которые фильтруют воду от нежелательных взвешенных веществ.
Жидкий силикат натрия реагирует в кислой среде с образованием твердого стекловидного геля.Это свойство делает его полезным в качестве связующего в цементированных продуктах, таких как бетон и абразивные круги. Это также отличный клей для стекла или фарфора.
Растворенное жидкое стекло традиционно используется в качестве консерванта для яиц. Свежие яйца, хранящиеся в прохладных условиях в вязком силикатном растворе, хранятся в течение нескольких месяцев.
Существует множество составов силиката натрия, в зависимости от количества Na 2 O и SiO 2 . Также существуют другие силикатные стекла, в которых натрий заменен другим щелочным металлом, например калием или литием.Некоторые стекла лучше подходят для конкретных целей, чем другие, но все они обладают одним и тем же свойством быть стекловидным твердым веществом, которое растворяется в воде с образованием щелочного раствора.
Химическая головоломка — Scientific American
Реклама
Следующий эксперимент легко выполнить даже тем, кто мало или совсем не обучался химии. Это дает представление о бесконечном разнообразии химических и физических изменений, которые один и тот же реагент может вызывать в других веществах.Четырнадцать стаканов, расставленных по семи парам, предстают перед зрителями, которым предлагается изучить их и их содержимое. Затем экспериментатор наливает одну и ту же жидкость в четырнадцать стаканов. Сразу становятся очевидными следующие противоречивые результаты: вещество, содержащееся в стакане А, становится настолько горячим, что стакан нельзя держать в руке. Вещество, содержащееся в стекле Ar, становится настолько холодным, что за пределами стекла быстро собирается иней.
Жидкость, содержащаяся в стакане B, была синей; он становится бесцветным.Жидкость, содержащаяся в стакане B ‘, была бесцветной; он становится синим.
Стекло G содержало прозрачную жидкость, которая становилась мутной. Стекло С »содержало мутную жидкость, которая становилась прозрачной.
Если зажженную спичку поместить в стекло D, находящееся на несколько дюймов выше уровня жидкости, будет видно, как во всех направлениях вспыхивает шумное пламя. Если тот же эксперимент проделать таким же образом со стеклом D », спичка тихо, но сразу же погаснет. Жидкость в стакане Е имела жгучий удушливый запах; он становится без запаха. Жидкость в стакане Е ‘не имела запаха; он приобретает такой неприятный запах, что его приходится выносить на улицу.Жидкость в стакане F была красной; он становится синим. Жидкость в стакане F ‘была синей; он становится красным.
Стекло G содержало твердое вещество, которое переходит в жидкое состояние. Стекло G ‘содержало прозрачную жидкость, которая мгновенно становилась твердой.
Каждое преобразование является результатом действия обычной соляной кислоты над каким-либо химическим веществом. Вот их природа и пропорции; вместимость стаканов должна быть около одной пинты.
Стакан А содержит 50 граммов гидрата натрия, растворенного в 100 кубических сантиметрах воды.Этот раствор заполняет примерно половину стакана. Во время эксперимента другая половина должна быть полностью заполнена соляной кислотой. Его следует наливать медленно, взбивая жидкость стеклянной или деревянной палочкой. Последние добавления кислоты вызывают закипание жидкости. Тогда будет обнаружено, что стекло содержит обычную поваренную соль, смешанную с избытком кислоты или гидрата натрия. Стакан A ‘наполнен мелкими кристаллами сульфата натрия, которые продаются фармацевтами для приема внутрь.Необходимо залить достаточным количеством соляной кислоты, чтобы она покрыла соль. Температура сразу идет намного ниже 32 град. F. Холод становится еще более интенсивным, если смесь взбалтывать.
Три четверти стакана В заполнены водой; затем в нем растворяется один дециграмм сульфата меди. Аммиак добавляется небольшими порциями до появления интенсивного синего цвета. Добавление соляной кислоты приведет к его исчезновению. Раствор двух сантиметров феррицианида калия в 100 кубических сантиметрах воды делают в стакане B ‘, и в него наливают еще один раствор из 3 сантиметров сульфата железа в 100 кубических сантиметрах воды.Затем добавляют немного нашатырного спирта, пока красивый синий цвет не исчезнет. Соляная кислота заставит его немедленно появиться.
Glass G содержит обычный раствор ацетата свинца, продаваемый фармацевтами для местного или наружного применения. Соляная кислота образует в нем плотный осадок хлорида свинца. Три четверти стакана С «заполнены водой, в которую добавлено около четверти чайной ложки гашеной извести, свободной от крупных частиц. Хлорид кальция, образующийся в результате действия соляной кислоты на известь, чрезвычайно растворим в воде.Несколько кусочков цинка осаждаются в стекле D. Пузырьки водорода с шумом воспламеняются, когда в стекло помещается спичка. Эксперимент свободен от опасности до тех пор, пока не будет предпринята попытка закрыть стакан.
Одна треть стакана D ‘заполнена древесной золой с достаточным количеством воды, чтобы образовалась жидкая паста. Углекислый газ — это газ, который быстро гасит спичку. Сто кубических сантиметров воды, пятьдесят кубических сантиметров нашатырного спирта и достаточно лакмусового раствора, чтобы
придают жидкости голубоватый оттенок, наливают в стакан Е.Во время эксперимента соляная кислота постепенно усиливается, пока голубоватый цвет внезапно не станет красноватым. Тогда обнаружится, что запах исчез.
Одна треть стакана E ‘заполнена водой, и в него бросают 8 граммов порошкообразного сульфида железа. Соляная кислота образует в стекле сероводород. Этот газ является активным веществом, содержащимся в некоторых минеральных водах, которым он придает характерный запах гнилых яиц. Это ядовито, но
количество, выделившееся во время эксперимента, невелико, а запах настолько силен, что делает воздух непригодным для дыхания задолго до того, как возникнет какая-либо опасность.Однако не следует нюхать его прямо над стеклом, а также нельзя, чтобы стекло оставалось в комнате дольше, чем это необходимо для обнаружения запаха.
Стекло F содержит ту же жидкость, что и стекло B, с добавлением одного сантиграмма алого анилина. Стакан F ‘содержит обыкновенный раствор голубой лакмуса.
Кальцинированная магнезия — это твердое вещество, которое заполняет около одной трети стекла G, а обычное сиропообразное растворимое стекло или раствор силиката натрия, продаваемый аптекарями, представляет собой жидкое вещество, которое мгновенно становится твердым в стекле G ‘, если его смешать с примерно одним раствором. треть его объема соляной кислоты.
Эта статья была первоначально опубликована под названием «Химическая головоломка» в Scientific American 97, 26, 472 (декабрь 1907 г.)
doi: 10.1038 / Scientificamerican12281907-472a
ОБ АВТОРЕ (-И)
Государственный колледж Коста-Рики
Читать This Next
В магазине
Scientific American
Информационный бюллетень
Станьте умнее. Подпишитесь на нашу новостную е-мэйл рассылку.
Поддержите научную журналистику
Откройте для себя науку, меняющую мир.Изучите наш цифровой архив 1845 года, в который входят статьи более 150 лауреатов Нобелевской премии.
Подпишитесь сейчас!
слоистых жидкостей
слоистых жидкостей
Вы когда-нибудь слышали фразу «масло и вода несовместимы»? Первый
мы проверим это выражение, а затем рассмотрим интересные комбинации нескольких
другие жидкости.
Нефть и вода
Вам понадобятся следующие материалы:
• ¼ стакана (60 мл) воды
• ¼ стакана (60 мл) растительного масла
• маленький стакан
• пищевой краситель
Сначала налейте воду в стакан.Добавьте пару капель пищевого красителя.
и перемешать. Затем добавьте масло. Что ты видишь? Какой слой сверху?
Плотно закройте стекло полиэтиленовой пленкой или рукой (если оно достаточно большое).
Держа стакан над раковиной (на случай, если вы пролили), встряхните стакан так, чтобы
что две жидкости тщательно перемешаны. Поставьте стакан и посмотрите, что
бывает. Смешиваются ли масло и вода?
Слово «смешиваемость» описывает, насколько хорошо смешиваются два вещества. Масло
и вода считается «несмешивающейся», потому что они не смешиваются.Масляный слой находится поверх воды из-за разницы в плотности
две жидкости. Плотность вещества — это отношение его массы (веса)
к его объему. Масло менее плотное, чем вода, поэтому оно находится сверху.
Следующий эксперимент исследует смешиваемость и плотность нескольких жидкостей.
Слоистые жидкости
Вам понадобятся следующие материалы:
• ¼ стакана (60 мл) темного кукурузного сиропа или меда
• чашки (60 мл) средства для мытья посуды
• ¼ стакана (60 мл) воды
• ¼ стакана (60 мл) растительного масла
• стакана (60 мл) медицинского спирта
• высокий стеклянный или прозрачный пластиковый стакан объемом 350 мл (12 унций)
• две другие чашки для смешивания
• пищевой краситель
Возьмите стакан на 12 унций.Будьте осторожны, чтобы сироп не попал на бокал;
налить сироп в середину стакана. Налейте достаточно сиропа, чтобы заполнить
стакан 1/6 пути.
После того, как вы добавили сироп или мед, слегка наклоните стакан и налейте
равномерное количество жидкости для мытья посуды, медленно стекая по краю стакана. Делает
жидкость для мытья посуды поплывет наверху сиропа или опустится на дно?
Затем смешайте несколько капель пищевого красителя с водой в одной из чашек для смешивания.Покрасьте медицинский спирт в другой цвет в другой чашке для смешивания.
Будьте осторожны, добавляйте следующие жидкости ОЧЕНЬ МЕДЛЕННО. Они менее вязкие (т. Е.
не такой густой) и смешивать легче, чем предыдущие жидкости. Мы не хотим их
смешивать. Слегка наклоните стакан и, медленно наливая его по стенке,
добавьте сначала цветную воду, затем растительное масло и, наконец, цветное
медицинский спирт.
На листе бумаги сделайте набросок стекла и его жидкостей, обозначив
положение каждой жидкости в вашем стакане.
Почему жидкости остаются разделенными? Можете ли вы придумать несколько способов, которыми жидкости
в стекле разные? Попытайтесь описать некоторые свойства, которые отличаются в каждом
жидкостей в стакане.
Одно свойство, которое различается у всех жидкостей, — это цвет. Другое свойство
уникальной для каждой жидкости является толщина (вязкость).
Свойство жидкостей, отвечающее за эффект наслоения, — это плотность.
Можете ли вы догадаться, какова взаимосвязь между плотностью жидкости и ее
положение в стакане?
Еще одним свойством разделения жидкостей является то, что некоторые из них не смешиваются.
жидкости, другими словами, они не смешиваются друг с другом.Как вы доказали в
Первый эксперимент, масло и вода — несмешиваемые жидкости. С другой стороны, вода
и медицинский спирт смешиваются и смешиваются друг с другом. Вода и
жидкость для мытья посуды также смешается.
Перемешайте жидкости в стакане и посмотрите, что происходит со слоями. Иметь
какой-либо из слоев смешан (смешиваются ли они друг с другом)? Подождите несколько минут
и посмотри еще раз. Отделились ли другие жидкости?
Альтернативная процедура: радуга в стакане.
Вам потребуются следующие материалы:
• пищевые красители четырех разных цветов (например, красный, желтый, зеленый, синий).
• пять высоких стаканов или прозрачных пластиковых стаканчиков
• ¾ стакана (180 г) сахарного песка
• столовая ложка мерки
• 1 стакан (240 мл) воды
В первый стакан добавьте одну столовую ложку (15 г) сахара. Во втором стакане
добавить две столовые ложки сахара, три в третий стакан и четыре в последний
стакан.Затем добавьте по три столовые ложки (45 мл) воды в каждый стакан и перемешивайте, пока
сахар растворяется. Если сахар в каком-либо из стаканов не растворяется,
добавьте еще одну столовую ложку (15 мл) воды во все стаканы и снова перемешайте.
Когда сахар полностью растворится, добавьте две-три капли красного пищевого красителя.
к первому стакану, желтому ко второму, зеленому к третьему и синему к
последний стакан.
В оставшемся стекле создадим нашу радугу.Наполните стакан примерно на четверть
пути с раствором синего сахара. Далее аккуратно добавляем зеленый раствор.
к стеклу. Сделайте это, поместив ложку в стакан чуть выше уровня.
синего раствора. Медленно влейте в ложку зеленый раствор, поднимая
ложку, чтобы держать ее чуть выше уровня жидкости, пока стакан не станет
наполовину. Добавьте желтый, а затем красный раствор таким же образом.
Что вы заметили в цветных решениях?
Количество растворенного в жидкости сахара влияет на ее плотность.Голубое решение
в нем растворено больше всего сахара, поэтому он самый плотный. Другие решения
менее плотны, чем синий раствор, поэтому плавают поверх него. Плотности
растворов должны быть очень близки, однако решения могут быть смешиваемыми,
поэтому вы увидите, что слои не образуют четко определенных границ, как в
первый эксперимент. Если все сделано достаточно осторожно, цвета должны оставаться относительно
отдельно друг от друга. Как вы думаете, что произойдет, если вы взболтаете жидкости
в стекле?
Back to Home Experiments
Что такое жидкое стекло? — Компания Liquid Glass
Теперь уже не так странно слышать, как люди говорят о жидком стекле или его свойствах.Люди привыкают к нему и начинают использовать его так же регулярно, как и другие чистящие и защитные средства. Но многие люди еще не знают, что такое жидкое стекло, откуда его производят и каков его состав.
Жидкое стекло — это силикат натрия (Na 2 SiO 3 ), щелочной силикат, который изучил Жан Баптист ван Гельмонт и определил как расплавленный песок с избытком щелочи. Силикат натрия представлен в виде порошка, который легко растворяется в воде, в результате получается щелочной раствор, который мы обычно называем жидким стеклом.
Жидкое стекло не создается естественным путем; мы производим его в наших лабораториях, чтобы концентрация была выше, чем при естественном процессе. Песок и щелочь — сырье, используемое для получения жидкого стекла. Первая фаза процесса заключается в смешивании соды, песка и воды, в результате получается жидкость. После этого этапа наступает термическая фаза, в которой карбонат натрия и сульфат натрия плавятся при высокой температуре; когда мы смешиваем его с жидкостью, полученной на первом этапе, получается силикат натрия.
Экологичное жидкое стекло
В Liquid Glass Nanotech мы заботимся об окружающей среде, и наша главная цель — создавать все наши продукты естественным образом, не нанося вреда природе. Устойчивое развитие — наша первая цель.
Жидкое стекло — это 100% натуральная технология; добывается из песка естественным путем. Для получения жидкого стекла мы не используем материалы, которых нет в природе.
Кроме того, простое использование жидкого стекла для защиты и очистки наших вещей и домов — это способ заботиться об окружающей среде, поскольку мы избегаем использования химикатов или токсичных веществ и продлеваем срок службы этих продуктов, снижая наши уровни отходов.
Награды, полученные нашим продуктом, подтверждают нашу работу как экологически чистую и демонстрируют, что мы заботимся о природе и что жидкое стекло обладает полезными свойствами.
Силикат натрия — безопасное и чистое вещество, это самый распространенный минерал на Земле, поэтому его использование не может нанести вред окружающей среде.
11.3 Растворимость — химия
Цели обучения
По окончании этого модуля вы сможете:
- Опишите влияние температуры и давления на растворимость
- Изложите закон Генри и используйте его в расчетах, касающихся растворимости газа в жидкости
- Объясните возможные степени растворимости жидко-жидких растворов
Представьте, что вы добавляете небольшое количество соли в стакан воды, перемешиваете, пока вся соль не растворится, а затем добавляете еще немного.Вы можете повторять этот процесс до тех пор, пока концентрация соли в растворе не достигнет своего естественного предела, предела, определяемого в первую очередь относительной силой сил притяжения растворенное вещество-растворенное вещество, растворенное вещество-растворитель и растворитель-растворитель, которые обсуждались в предыдущих двух модулях этой главы. . Вы можете быть уверены, что достигли этого предела, потому что независимо от того, как долго вы перемешиваете раствор, остается нерастворенная соль. Концентрация соли в растворе на этом этапе называется его растворимостью.
Растворимость растворенного вещества в конкретном растворителе — это максимальная концентрация, которая может быть достигнута в данных условиях, когда процесс растворения составляет при равновесии .{-} (водн.) [/ латекс]
Когда концентрация растворенного вещества равна его растворимости, говорят, что раствор на насыщен этим растворенным веществом. Если концентрация растворенного вещества меньше его растворимости, раствор считается ненасыщенным . Раствор с относительно низкой концентрацией растворенного вещества называется разбавленным, а раствор с относительно высокой концентрацией — концентрированным.
Если мы добавим еще соли к насыщенному раствору соли, мы увидим, что она падает на дно и больше не растворяется.Фактически, добавленная соль растворяется, что выражается прямым направлением уравнения растворения. Сопровождая этот процесс, растворенная соль будет выпадать в осадок, как показано обратным направлением уравнения. Говорят, что система находится в равновесии, когда эти два взаимных процесса происходят с равными скоростями, и поэтому количество нерастворенной и растворенной соли остается постоянным. Подтверждение одновременного протекания процессов растворения и осаждения обеспечивается тем, что количество и размеры нерастворенных кристаллов соли будут меняться со временем, хотя их общая масса останется прежней.
Используйте это интерактивное моделирование для приготовления различных насыщенных растворов.
Могут быть приготовлены растворы, в которых концентрация растворенного вещества на превышает его растворимость. Такие решения называются пересыщенными , и они являются интересными примерами неравновесных состояний . Например, газированный напиток в открытом контейнере, который еще не «разложился», перенасыщен газообразным диоксидом углерода; со временем концентрация CO 2 будет уменьшаться, пока не достигнет своего равновесного значения.
Посмотрите это впечатляющее видео, демонстрирующее осаждение ацетата натрия из перенасыщенного раствора.
В предыдущем модуле этой главы обсуждалось влияние сил межмолекулярного притяжения на образование раствора. Химические структуры растворенного вещества и растворителя определяют типы возможных сил и, следовательно, являются важными факторами при определении растворимости. Например, в аналогичных условиях растворимость кислорода в воде примерно в три раза больше, чем у гелия, но в 100 раз меньше растворимости хлорметана, CHCl 3 .Учитывая роль химической структуры растворителя, обратите внимание, что растворимость кислорода в жидком углеводородном гексане, C 6 H 14 , примерно в 20 раз больше, чем в воде.
Другие факторы также влияют на растворимость данного вещества в данном растворителе. Одним из таких факторов является температура, растворимость газа обычно снижается с повышением температуры (рис. 1). Это одно из основных последствий теплового загрязнения природных водоемов.
Рис. 1. Растворимость этих газов в воде уменьшается с повышением температуры. Все растворимости измеряли при постоянном давлении газа 101,3 кПа (1 атм) над растворами.
Когда температура реки, озера или ручья повышается до аномально высокой, обычно из-за сброса горячей воды в результате какого-либо промышленного процесса, растворимость кислорода в воде снижается. Пониженный уровень растворенного кислорода может иметь серьезные последствия для здоровья водных экосистем и, в тяжелых случаях, может привести к крупномасштабной гибели рыбы (рис. 2).
Рис. 2. (a) Маленькие пузырьки воздуха в этом стакане с охлажденной водой образовались, когда вода нагрелась до комнатной температуры и растворимость растворенного в ней воздуха уменьшилась. (b) Пониженная растворимость кислорода в природных водах, подверженных тепловому загрязнению, может привести к крупномасштабной гибели рыбы. (кредит а: модификация работы Лиз Уэст; кредит б: модификация работы Службы охраны рыбных ресурсов и дикой природы США)
На растворимость газообразного растворенного вещества также влияет парциальное давление растворенного вещества в газе, которому подвергается раствор.Растворимость газа увеличивается с увеличением давления газа. Газированные напитки — прекрасная иллюстрация этой взаимосвязи. Процесс газирования включает в себя воздействие на напиток относительно высокого давления газообразного диоксида углерода и затем герметизацию контейнера с напитком, тем самым насыщая напиток CO 2 при этом давлении. Когда контейнер с напитком открывается, слышится знакомое шипение, когда давление углекислого газа сбрасывается, и обычно видно, что часть растворенного углекислого газа выходит из раствора в виде маленьких пузырьков (рис. 3).В этот момент напиток на перенасыщен диоксидом углерода на , и со временем концентрация растворенного диоксида углерода снизится до своего равновесного значения, и напиток станет «плоским».
Рисунок 3. Открытие бутылки с газированным напитком снижает давление газообразного диоксида углерода над напитком. Растворимость CO 2 , таким образом, снижается, и можно увидеть, как растворенных диоксида углерода покидают раствор в виде небольших пузырьков газа.(кредит: модификация работы Деррика Кутзи)
Для многих газообразных растворенных веществ соотношение между растворимостью C г и парциальным давлением P г является пропорциональным соотношением:
[латекс] C _ {\ text {g}} = kP _ {\ text {g}} [/ латекс]
, где k — константа пропорциональности, которая зависит от идентичности газообразного растворенного вещества и растворителя, а также от температуры раствора. Это математическое утверждение закона Генри : Количество идеального газа, растворяющегося в определенном объеме жидкости, прямо пропорционально давлению газа.
Пример 1
Применение закона Генри
При 20 ° C концентрация растворенного кислорода в воде, подверженной воздействию газообразного кислорода при парциальном давлении 101,3 кПа (760 торр), составляет 1,38 × 10 −3 моль л −1 . Используйте закон Генри, чтобы определить растворимость кислорода, когда его парциальное давление составляет 20,7 кПа (155 торр), приблизительное давление кислорода в атмосфере Земли.
Раствор
Согласно закону Генри для идеального раствора растворимость C г газа (1.38 × 10 −3 моль л (в данном случае −1 ) прямо пропорционально давлению, P г , нерастворенного газа над раствором (101,3 кПа, или 760 торр, в данном случае ). Поскольку нам известны как C g , так и P g , мы можем изменить это выражение, чтобы найти k .
[латекс] \ begin {array} {r @ {{} = {}} l} C _ {\ text {g}} & kP _ {\ text {g}} \\ [0.5em] k & \ frac {C_ {\ text {g}}} {P _ {\ text {g}}} \\ [0.{-1} [/ латекс]
Обратите внимание, что для выражения величин, участвующих в такого рода вычислениях, могут использоваться различные единицы. Допускается любая комбинация единиц, которая подчиняется ограничениям размерного анализа.
Проверьте свои знания
Воздействие на образец воды объемом 100,0 мл при 0 ° C в атмосфере, содержащей газообразное растворенное вещество при давлении 20,26 кПа (152 торр), привело к растворению 1,45 × 10 −3 г растворенного вещества. Используйте закон Генри, чтобы определить растворимость этого газообразного растворенного вещества, когда его давление равно 101.3 кПа (760 торр).
Ответ:
7,25 × 10 −3 в 100,0 мл или 0,0725 г / л
Декомпрессионная болезнь или «изгибы»
Декомпрессионная болезнь (ДКБ) или «изгибы» — это эффект повышенного давления воздуха, вдыхаемого аквалангистами при плавании под водой на значительной глубине. В дополнение к давлению, оказываемому атмосферой, водолазы подвергаются дополнительному давлению из-за воды над ними, испытывая увеличение примерно на 1 атм на каждые 10 м глубины.Следовательно, воздух, вдыхаемый водолазом во время погружения, содержит газы при соответствующем более высоком давлении окружающей среды, и концентрация газов, растворенных в крови водолаза, пропорционально выше в соответствии с законом Генри.
По мере того, как ныряльщик поднимается на поверхность воды, давление окружающей среды уменьшается, и растворенные газы становятся менее растворимыми. Если всплытие слишком быстрое, газы, выходящие из крови дайвера, могут образовывать пузырьки, которые могут вызывать различные симптомы, от сыпи и боли в суставах до паралича и смерти.Чтобы избежать DCS, дайверы должны подниматься с глубины на относительно медленных скоростях (10 или 20 м / мин) или иным образом делать несколько декомпрессионных остановок, делая паузу на несколько минут на заданной глубине во время всплытия. Когда эти превентивные меры оказываются безуспешными, дайверам с ДКБ часто проводят гипербарическую кислородную терапию в сосудах под давлением, называемых декомпрессионными (или рекомпрессионными) камерами (рис. 4).
Рис. 4. (a) Водолазы ВМС США проходят обучение в рекомпрессионной камере. (б) Дайверы получают гипербарическую кислородную терапию.
Отклонения от закона Генри наблюдаются, когда происходит химическая реакция между газообразным растворенным веществом и растворителем. Таким образом, например, растворимость аммиака в воде не увеличивается так быстро с увеличением давления, как предсказывается законом, потому что аммиак, являясь основанием, до некоторой степени реагирует с водой с образованием ионов аммония и гидроксид-ионов.
Газы могут образовывать перенасыщенные растворы. Если раствор газа в жидкости готовится либо при низкой температуре, либо под давлением (или в обоих случаях), то по мере того, как раствор нагревается или когда давление газа снижается, раствор может стать перенасыщенным.В 1986 году более 1700 человек в Камеруне погибли, когда облако газа, почти наверняка углекислого газа, вырвалось из озера Ньос (рис. 5), глубокого озера в вулканическом кратере. Вода на дне озера Ниос насыщена углекислым газом из-за вулканической активности под озером. Считается, что озеро претерпело оборот из-за постепенного нагрева из-под озера, и более теплая, менее плотная вода, насыщенная углекислым газом, достигла поверхности. В результате было выпущено огромное количество растворенного CO 2 , и бесцветный газ, который плотнее воздуха, потек по долине под озером и задушил людей и животных, живущих в долине.
Рис. 5. (a) Считается, что катастрофа 1986 года, унесшая жизни более 1700 человек возле озера Ниос в Камеруне, возникла в результате выброса из озера большого количества углекислого газа. (b) С тех пор была установлена вентиляционная труба CO 2 , которая помогает медленно и контролируемым образом выводить газ из озера и предотвратить подобную катастрофу в будущем. (кредит а: модификация работы Джека Локвуда; кредит б: модификация работы Билла Эванса)
Мы знаем, что некоторые жидкости смешиваются друг с другом во всех пропорциях; другими словами, они обладают бесконечной взаимной растворимостью и считаются смешиваемыми .Этанол, серная кислота и этиленгликоль (популярные для использования в качестве антифриза, изображены на рисунке 6) являются примерами жидкостей, которые полностью смешиваются с водой. Моторное масло для двухтактных двигателей смешивается с бензином.
Рисунок 6. Вода и антифриз смешиваются; смеси этих двух веществ однородны во всех пропорциях. (кредит: «dno1967» / Wikimedia commons)
Жидкости, которые смешиваются с водой во всех пропорциях, обычно являются полярными веществами или веществами, образующими водородные связи. Для таких жидкостей диполь-дипольные притяжения (или водородные связи) молекул растворенного вещества с молекулами растворителя по крайней мере такие же сильные, как между молекулами в чистом растворенном веществе или в чистом растворителе.Следовательно, два типа молекул легко смешиваются. Точно так же неполярные жидкости смешиваются друг с другом, потому что нет заметной разницы в силе межмолекулярного притяжения растворенное вещество-растворенное вещество, растворитель-растворитель и растворенное вещество-растворитель. Растворимость полярных молекул в полярных растворителях и неполярных молекул в неполярных растворителях снова является иллюстрацией химической аксиомы «подобное растворяется в подобном».
Две жидкости, которые не смешиваются в значительной степени, называются несмешивающимися .Слои образуются, когда мы наливаем в одну емкость несмешивающиеся жидкости. Бензин, масло (рис. 7), бензол, четыреххлористый углерод, некоторые краски и многие другие неполярные жидкости не смешиваются с водой. Притяжение между молекулами таких неполярных жидкостей и полярными молекулами воды малоэффективно. Единственное сильное притяжение в такой смеси происходит между молекулами воды, поэтому они эффективно вытесняют молекулы неполярной жидкости. Различие между несмешиваемостью и смешиваемостью на самом деле является одним из степеней, так что смешивающиеся жидкости имеют бесконечную взаимную растворимость, в то время как жидкости, которые считаются несмешиваемыми, имеют очень низкую (хотя и не нулевую) взаимную растворимость.
Рис. 7. Вода и масло не смешиваются. Смеси этих двух веществ образуют два отдельных слоя с менее плотным маслом, плавающим над водой. (кредит: «Yortw» / Flickr)
Две жидкости, такие как бром и вода, которые обладают средней взаимной растворимостью, считаются частично смешиваемыми . Две частично смешивающиеся жидкости при смешивании обычно образуют два слоя. В случае смеси брома и воды верхний слой — это вода, насыщенная бромом, а нижний слой — бром, насыщенный водой.Поскольку бром неполярен и, следовательно, не очень хорошо растворяется в воде, водный слой лишь слегка обесцвечивается из-за растворенного в нем ярко-оранжевого брома. Поскольку растворимость воды в броме очень низкая, нет заметного влияния на темный цвет слоя брома (рис. 8).
Рис. 8. Бром (темно-оранжевая жидкость слева) и вода (прозрачная жидкость в центре) частично смешиваются. Верхний слой смеси справа — это насыщенный раствор брома в воде; нижний слой — насыщенный раствор воды в броме.(Источник: Пол Флауэрс)
Зависимость растворимости от температуры для ряда неорганических твердых веществ в воде показана кривыми растворимости на рисунке 9. Анализ этих данных указывает на общую тенденцию увеличения растворимости с температурой, хотя есть исключения, как показано на примере ионного соединения церия. сульфат.
Рис. 9. На этом графике показано, как растворимость некоторых твердых веществ изменяется с температурой.
Температурную зависимость растворимости можно использовать для приготовления перенасыщенных растворов определенных соединений.Раствор может быть насыщен соединением при повышенной температуре (где растворенное вещество более растворимо), а затем охлажден до более низкой температуры без осаждения растворенного вещества. Полученный раствор содержит растворенное вещество в концентрации, превышающей его равновесную растворимость при более низкой температуре (т.е. он перенасыщен), и является относительно стабильным. Осаждение избытка растворенного вещества может быть инициировано добавлением затравочного кристалла (см. Видео в разделе «Ссылка на обучение» ранее в этом модуле) или путем механического перемешивания раствора.Некоторые грелки для рук, такие как изображенный на рисунке 10, используют это поведение.
Рисунок 10. Этот грелка для рук выделяет тепло, когда ацетат натрия в перенасыщенном растворе выпадает в осадок. Осаждение растворенного вещества инициируется механической ударной волной, генерируемой, когда гибкий металлический диск в растворе «щелкает». (кредит: модификация работы «Велела» / Wikimedia Commons)
На этом видео показан процесс кристаллизации в грелке для рук.
Степень растворения одного вещества в другом определяется несколькими факторами, включая типы и относительные силы сил межмолекулярного притяжения, которые могут существовать между атомами, ионами или молекулами веществ. Эта склонность к растворению количественно определяется растворимостью вещества, его максимальной концентрацией в растворе, находящемся в равновесии при определенных условиях. Насыщенный раствор содержит растворенное вещество в концентрации, равной его растворимости. Перенасыщенный раствор — это раствор, в котором концентрация растворенного вещества превышает его растворимость — неравновесное (нестабильное) состояние, которое приведет к осаждению растворенного вещества, когда раствор соответствующим образом нарушен.Смешивающиеся жидкости растворимы во всех пропорциях, а несмешивающиеся жидкости обладают очень низкой взаимной растворимостью. Растворимость газообразных растворенных веществ уменьшается с повышением температуры, в то время как растворимость большинства, но не всех твердых растворенных веществ увеличивается с увеличением температуры. Концентрация газообразного растворенного вещества в растворе пропорциональна парциальному давлению газа, воздействию которого раствор подвергается, соотношение, известное как закон Генри.
- [латекс] C _ {\ text {g}} = kP _ {\ text {g}} [/ latex]
Химия: упражнения в конце главы
- Предположим, вам представлен прозрачный раствор тиосульфата натрия, Na 2 S 2 O 3 .Как определить, является ли раствор ненасыщенным, насыщенным или перенасыщенным?
- Перенасыщенные растворы большинства твердых веществ в воде получают путем охлаждения насыщенных растворов. Перенасыщенные растворы большинства газов в воде получают нагреванием насыщенных растворов. Объясните причины разницы в двух процедурах.
- Предложите объяснение наблюдений, что этанол, C 2 H 5 OH, полностью смешивается с водой и что этантиол, C 2 H 5 SH, растворим только до степени 1.5 г на 100 мл воды.
- Рассчитайте массовый процент KBr в насыщенном растворе KBr в воде при 10 ° C. См. Полезные данные на рисунке 9 и сообщайте вычисленный процент с точностью до одной значащей цифры.
- Ожидается, что какой из следующих газов наиболее растворим в воде? Объясните свои рассуждения.
(а) CH 4
(б) CCl 4
(в) CHCl 3
- При 0 ° C и 1,00 атм. 0,70 г O 2 может раствориться в 1 л воды.Сколько граммов O 2 растворяется в 1 л воды при 0 ° C и 4,00 атм?
- См. Рисунок 3.
(a) Как изменилась концентрация растворенного CO 2 в напитке при открытии бутылки?
(б) Что вызвало это изменение?
(c) Является ли напиток ненасыщенным, насыщенным или перенасыщенным CO 2 ?
- Константа закона Генри для CO 2 составляет 3,4 × 10 −2 M / атм при 25 ° C.Какое давление углекислого газа необходимо для поддержания концентрации CO 2 0,10 M в банке лимонно-лаймовой соды?
- Константа закона Генри для O 2 составляет 1,3 × 10 −3 M / атм при 25 ° C. Какая масса кислорода растворилась бы в 40-литровом аквариуме при 25 ° C, если принять атмосферное давление 1,00 атм и что парциальное давление O 2 равно 0,21 атм?
- Сколько литров газообразного HCl, измеренного при 30,0 ° C и 745 торр, необходимо для приготовления 1.25 л раствора соляной кислоты 3.20- M ?
Глоссарий
- Закон Генри
- закон, устанавливающий пропорциональную зависимость между концентрацией растворенного газа в растворе и парциальным давлением газа, контактирующего с раствором
- несмешиваемый
- с незначительной взаимной растворимостью; обычно относится к жидким веществам
- смешиваемый
- взаимно растворим во всех пропорциях; обычно относится к жидким веществам
- частично смешивается
- умеренной взаимной растворимости; обычно относится к жидким веществам
- насыщенный
- концентрации, равной растворимости; содержащая максимально возможную концентрацию растворенного вещества для данной температуры и давления
- растворимость
- степень, до которой растворенное вещество может быть растворено в воде или любом растворителе
- перенасыщенный
- концентрации, превышающей растворимость; неравновесное состояние
- ненасыщенные
- с концентрацией меньше растворимости
Решения
Ответы на упражнения в конце главы по химии
2.Растворимость твердых веществ обычно уменьшается при охлаждении раствора, в то время как растворимость газов обычно уменьшается при нагревании.
4. 40%
6. 2,80 г
8. 2.9 атм
10. 102 л HCl
Лабораторная посуда — Лаборатория образцов
Бюретка
Бюретки — это специализированные измерительные приборы. Для точного дозирования жидкости и контроля оттока жидкости к бюреткам прилагается пережимной зажим, запорный кран или клапан.Бюретки изготовлены из стандартного, толерантного лабораторного боросиликатного стекла, чтобы избежать поломки и растрескивания. Мы предлагаем градуированные бюретки с маркировкой из белой эмали, которая улучшает видимость при использовании темных растворов, а также облегчает считывание показаний мениска. Зажим бюретки или несколько зажимов с тремя пальцами прикрепляются к боковой стороне бюретки при установке в вертикальном положении, поскольку одиночный зажим с тремя пальцами может раскачиваться или отклоняться в вертикальном направлении.
Процедура
- Очистите бюретку, промыв ее тем же раствором, который используется для титрования.
- Заполните бюретку выше нулевой отметки, чтобы было достаточно жидкости для заполнения запорного крана или поворотного клапана. Удалите пузырьки воздуха из клапанов.
- Залейте интересующий раствор в бюретку, чтобы установить нулевую точку на уровне глаз.
- Вытрите капли с наконечника.
- Медленно откройте кран и начните титрование. Убедитесь, что кончик бюретки не касается стенки сосуда для титрования. Убедитесь, что сосуд стоит на мешалке, чтобы гарантировать перемешивание титрованного раствора.
- Закройте клапан, как только изменится цвет раствора.
- Считайте объем выданного раствора.
Типы бюреток
Есть четыре типа бюреток.
Бюретки Мора — наименее точные бюретки. У них нет запорных кранов на конце; поэтому для регулирования потока жидкости из бюретки используются гибкие трубки с зажимами.
Бюретка Гисслера
широко используется в лабораторных условиях.На наконечнике зажат запорный кран. Некоторые бюретки Giessler имеют трехходовые краны для облегчения наполнения. При одностороннем перемещении крана бюретка заполняется, и если ее повернуть на 180 °, бюретка опорожняется.
Для измерений арифметические операции не требуются. Поскольку их можно быстро и эффективно заполнить точно до 0,00 мл, количество диспергированного раствора определяется одновременно. Благодаря точным измерениям ошибки, связанные с арифметическими вычислениями, сведены к минимуму. Бюретки этого типа заполняются путем преднамеренного переполнения верхней части, которая закрыта и имеет дренаж для сбора перелива.Верхняя часть автоматической бюретки не откалибрована, поэтому, если наливается меньше жидкости, чем содержится в этой области, удаленное количество не может быть определено.
Дозирующая бюретка может вместить до одного литра жидкости и может быстро и эффективно дозировать жидкость. Его точность составляет около ± 0,5% от общего объема.
Уход за бюретками и их использование
Бюретки более склонны к скалыванию или растрескиванию, так как они редко подвергаются термической упрочнению на вершине или в конце.Помимо наконечника, не менее важен уход за запорными кранами бюретки. Проверьте запорные краны на предмет заклинивания, протечек и постоянства потока жидкости. Стеклянные краны легко ломаются, поэтому осторожно снимите заглушку крана бюретки, очистите заглушку и цилиндр и снова смазать. Удалите смазку из запорного крана, если он протекает, и замените пробку. Плотно затяните пробку, но не поворачивайте ее.
Не используйте смазку для запорных кранов на силиконовой основе для бюреток, если этого не требует природа химикатов, потому что смазки на силиконовой основе нуждаются в постоянной очистке и замене для сохранения их скользкости.Силиконовая смазка может быть недорогой в краткосрочной перспективе, но последствия будут дорогостоящими. Вместо силиконовой смазки можно использовать тефлоновый запорный кран или поворотный клапан. Периодически проверяйте запорные краны тефлоновой смазки на наличие царапин. Никогда не храните раствор в бюретке. Щелочные растворы могут вступать в реакцию со стеклом и вызывать замерзание стеклянного крана, поэтому никогда не храните щелочные растворы в бюретке. Кроме того, щелочной раствор может вступить в реакцию со стеклом и создать шероховатую поверхность, которая может поцарапать тефлоновую пробку.
При заполнении бюретки сначала удалите все пузырьки воздуха в области наконечника. Если пузырек выходит во время измерения, он может занять место измеренной жидкости, но никогда не покидает бюретку. Чтобы удалить пузырек, переполните бюретку и полностью откройте запорный кран, чтобы вытолкнуть пузырек наружу.
Стеклянные пробирки
Пробирка — это тонкий стеклянный сосуд с закругленным дном, предназначенный для хранения небольших количеств химикатов и имеющий расширяющуюся кромку для облегчения наливания.Пробирки могут содержать жидкие или твердые химические вещества и могут использоваться для сдерживания небольших химических реакций. Тонкость пробирки эффективно снижает распространение любых паров, которые могут образоваться в результате реакции. Кроме того, пробирка позволяет пользователю нагревать образец на пламени.
Использование стеклянных пробирок для культивирования
- Стеклянные пробирки для культивирования обычно используются в химических лабораториях для работы с химическими веществами, особенно для качественных экспериментов и анализов.Их круглое дно и вертикальные стороны уменьшают потерю жидкости и массы при розливе. Кроме того, круглое дно облегчает промывку и позволяет удобно контролировать содержимое.
- Пробирки — полезные сосуды для нагрева небольших количеств жидкостей или твердых веществ на горелке Бунзена. Его шейка обычно удерживает трубку зажимом или щипцами. Слегка наклонив трубку, ее дно можно нагреть в пламени до сотен градусов, в то время как горловина остается относительно холодной, позволяя парам конденсироваться на ее стенках.
- Пробирка с водой и перевернутая трубка в стакане с водой используются для улавливания газов при электролизе.
- Пробирку с пробкой можно также использовать для временного хранения химических или биологических образцов.
- В клинической медицине стерильные пробирки с удаленным воздухом используются для сбора и хранения образцов физиологической жидкости, такой как кровь, моча, гной и синовиальная жидкость.
Глава 7 — Растворы — Химия
Глава 7: Растворы A стехиометрия раствора
7.1 Введение
7.2 Типы решений
7.3 Растворимость
7,4 Температура и растворимость
7.5 Влияние давления на растворимость газов: закон Генри
7,6 Твердые гидраты
7.7 Концентрация раствора
7.7.1 Молярность
7.7.2 Количество частей в решениях
7,8 Разведения
7.9 Концентрации ионов в растворе
7.10 Внимание к окружающей среде: загрязнение свинцом
7.11 Резюме
7.12 Ссылки
7.1 Введение:
Напомним из главы 1, что растворов определены как гомогенные смеси, которые перемешаны так тщательно, что ни один компонент не может наблюдаться независимо от другого. Решения повсюду вокруг нас. Например, воздух — это решение.Если вы живете рядом с озером, рекой или океаном, этот водоем — не чистый H 2 O, но, скорее всего, решение. Многие из того, что мы пьем, например газированные напитки, кофе, чай и молоко, являются растворами. Решения — большая часть повседневной жизни. Большая часть химии, происходящей вокруг нас, происходит в растворе. Фактически, большая часть химии, которая происходит в нашем собственном организме, происходит в растворе, и многие растворы, такие как раствор лактата Рингера для внутривенного введения, важны для здравоохранения. В нашем понимании химии нам нужно немного разбираться в растворах.В этой главе вы узнаете об особых характеристиках решений, их характеристиках и некоторых их свойствах.
Навыки для развития
- Определите эти термины: раствор, растворенное вещество и растворитель.
- Различают растворы, смеси и коллоиды.
- Опишите различные типы решений.
- Различают ненасыщенные, насыщенные и пересыщенные растворы.
Главный компонент раствора называется растворителем , а второстепенный компонент (ы) называется растворенным веществом .Если оба компонента в растворе составляют 50%, термин «растворенное вещество» может относиться к любому компоненту. Когда газообразный или твердый материал растворяется в жидкости, газ или твердый материал называется растворенным веществом. Когда две жидкости растворяются друг в друге, основной компонент называется растворителем , а второстепенный компонент называется растворенным веществом .
Многие химические реакции протекают в растворах, и растворы также тесно связаны с нашей повседневной жизнью.Воздух, которым мы дышим, жидкости, которые мы пьем, и жидкости в нашем теле — все это решения. Кроме того, нас окружают такие решения, как воздух и вода (в реках, озерах и океанах).
По теме решений мы включаем следующие разделы.
- Типы растворов: газообразные, жидкие и твердые растворы в зависимости от состояния раствора.
- Стехиометрия раствора: выражение концентрации в различных единицах (масса на единицу объема, моль на единицу объема, процент и доли), расчеты стехиометрии реакции с использованием растворов.
- Растворы электролитов: растворы кислот, оснований и солей, в которых растворенные вещества диссоциируют на положительные и отрицательные гидратированные ионы.
- Метатезис или обменные реакции: реакция электролитов, приводящая к нейтральным молекулам, газам и твердым веществам.
Решение проблем стехиометрии раствора требует концепций, представленных в стехиометрии в главе 6, которая также обеспечивает основу для обсуждения реакций.
(Вернуться к началу)
7.2 типа решений
В главе 1 вы познакомились с концепцией смеси , которая представляет собой вещество, состоящее из двух или более веществ. Напомним, что смеси могут быть двух типов: гомогенные и гетерогенные, где гомогенные смеси сочетаются настолько тесно, что их можно рассматривать как единое вещество, хотя это не так. С другой стороны, гетерогенные смеси неоднородны и имеют участки смеси, которые отличаются от других участков смеси.Гомогенные смеси можно разделить на две категории: коллоиды и растворы. Коллоид — это смесь, содержащая частицы диаметром от 2 до 500 нм. Коллоиды кажутся однородными по своей природе и имеют одинаковый состав во всем, но являются мутными или непрозрачными. Молоко — хороший пример коллоида. Истинные растворы имеют размер частиц типичного иона или небольшой молекулы (от 0,1 до 2 нм в диаметре) и прозрачны, хотя могут быть окрашены. В этой главе основное внимание будет уделено характеристикам истинных решений.
Материал существует в трех состояниях: твердом, жидком и газообразном. Решения также существуют во всех этих состояниях:
- Газовые смеси обычно однородны и обычно представляют собой газо-газовые растворы . Для количественной обработки такого типа растворов мы посвятим единицу газам. Атмосфера представляет собой газообразный раствор, состоящий из азота, кислорода, аргона, двуокиси углерода, воды, метана и некоторых других второстепенных компонентов. Некоторые из этих компонентов, такие как вода, кислород и углекислый газ, могут различаться по концентрации в разных местах на Земле в зависимости от таких факторов, как температура и высота над уровнем моря.
- Когда молекулы газа, твердого вещества или жидкости диспергированы и смешаны с молекулами жидкости, гомогенные (однородные) состояния называются жидкими растворами . Твердые вещества, жидкости и газы растворяются в жидком растворителе с образованием жидких растворов. В этой главе большая часть химии, которую мы будем обсуждать, происходит в жидких растворах, в которых вода является растворителем.
- Многие сплавы, керамика и полимерные смеси представляют собой твердые растворы . В определенных пределах медь и цинк растворяются друг в друге и затвердевают с образованием твердых растворов, называемых латунью.Серебро, золото и медь образуют множество различных сплавов, уникальных по цвету и внешнему виду. Сплавы и другие твердые растворы важны в мире химии материалов.
(Вернуться к началу)
7.3 Растворимость
Максимальное количество вещества, которое может быть растворено в данном объеме растворителя, называется растворимостью . Часто растворимость в воде выражается в граммах / 100 мл. Раствор, не достигший максимальной растворимости, называется ненасыщенным раствором . Это означает, что к растворителю все еще может быть добавлено больше растворенного вещества, и растворение все равно будет происходить.
Раствор, достигший максимальной растворимости, называется насыщенным раствором . Если в этот момент добавить больше растворенного вещества, оно не растворится в растворе. Вместо этого он останется в осадке в виде твердого вещества на дне раствора. Таким образом, часто можно сказать, что раствор является насыщенным, если присутствует дополнительное растворенное вещество (оно может существовать в виде другой фазы, такой как газ, жидкость или твердое вещество).В насыщенном растворе нет чистого изменения количества растворенного вещества, но система никоим образом не статична. Фактически растворенное вещество постоянно растворяется и откладывается с одинаковой скоростью. Такое явление называется равновесием . Например:
В особых случаях раствор может быть перенасыщенным . Перенасыщенные растворы — это растворы, в которых растворенные вещества растворяются за пределами нормальной точки насыщения.Обычно для создания перенасыщенного раствора требуются такие условия, как повышенная температура или давление. Например, ацетат натрия имеет очень высокую растворимость при 270 К. При охлаждении такой раствор остается растворенным в так называемом метастабильном состоянии . Однако, когда к раствору добавляют кристалл затравки , дополнительное растворенное вещество быстро затвердевает. В процессе кристаллизации выделяется тепло, и раствор становится теплым. Обычные грелки для рук используют этот химический процесс для выработки тепла.
Видео 7.1: Видео, показывающее кристаллизацию перенасыщенного раствора ацетата натрия. Видео: Школа естественных и математических наук Северной Каролины
Итак, как мы можем предсказать растворимость вещества?
Одна полезная классификация материалов — полярность. Читая о ковалентных и ионных соединениях в главах 3 и 4, вы узнали, что ионные соединения имеют самую высокую полярность, образуя полные катионы и анионы внутри каждой молекулы, поскольку электроны передаются от одного атома к другому.Вы также узнали, что ковалентные связи могут быть полярными или неполярными по своей природе в зависимости от того, разделяют ли атомы, участвующие в связи, электроны неравномерно или поровну, соответственно. Напомним, что по разнице электроотрицательностей можно определить полярность вещества. Обычно ионная связь имеет разность электроотрицательностей 1,8 или выше, тогда как полярная ковалентная связь составляет от 0,4 до 1,8, а неполярная ковалентная связь составляет 0,4 или ниже.
Рисунок 7.1 Диаграмма разности электроотрицательностей. Диаграмма выше является руководством для определения типа связи между двумя разными атомами. Взяв разницу между значениями электроотрицательности для каждого из атомов, участвующих в связи, можно предсказать тип связи и полярность. Обратите внимание, что полный ионный характер достигается редко, однако, когда металлы и неметаллы образуют связи, они называются в соответствии с правилами ионного связывания.
Вещества с нулевой или низкой разностью электроотрицательности, такие как H 2 , O 2 , N 2 , CH 4 , CCl 4 , являются неполярными соединениями , тогда как H 2 O, NH 3 , CH 3 OH, NO, CO, HCl, H 2 S, PH 3 Более высокая разница электроотрицательности — это полярных соединений .Обычно соединения, имеющие сходную полярность, растворимы друг в друге. Это можно описать правилом:
Like Dissolves Like.
Это означает, что вещества должны иметь одинаковые межмолекулярные силы для образования растворов. Когда растворимое растворенное вещество вводится в растворитель, частицы растворенного вещества могут взаимодействовать с частицами растворителя. В случае твердого или жидкого растворенного вещества взаимодействия между частицами растворенного вещества и частицами растворителя настолько сильны, что отдельные частицы растворенного вещества отделяются друг от друга и, окруженные молекулами растворителя, входят в раствор.(Газообразные растворенные вещества уже отделены от составляющих частиц, но концепция окружения частицами растворителя все еще применима.) Этот процесс называется solvatio n и проиллюстрирован на рисунке 7.2. Когда растворителем является вода, вместо сольватации используется слово гидратация .
Обычно полярные растворители растворяют полярные растворенные вещества, тогда как неполярные растворители растворяют неполярные растворенные вещества. В целом процесс растворения зависит от силы притяжения между частицами растворенного вещества и частицами растворителя.Например, вода — это высокополярный растворитель, способный растворять многие ионные соли. На рис. 7.2 показан процесс растворения, в котором вода действует как растворитель для растворения кристаллической соли хлорида натрия (NaCl). Обратите внимание, что когда ионные соединения растворяются в растворителе, они распадаются на свободно плавающие ионы в растворе. Это позволяет соединению взаимодействовать с растворителем. В случае растворения хлорида натрия в воде ион натрия притягивается к частичному отрицательному заряду атома кислорода в молекуле воды, тогда как ион хлорида притягивается к частичным положительным атомам водорода.
Рисунок 7.2: Процесс растворения. Когда ионная соль, такая как хлорид натрия, показанная на (A), вступает в контакт с водой, молекулы воды диссоциируют ионные молекулы хлорида натрия в их ионное состояние, что показано в виде молекулярной модели на (B) твердого тела. кристаллическая решетка хлорида натрия и (C) хлорид натрия, растворенный в водном растворителе. (Фотография хлорида натрия предоставлена Крисом 73).
Многие ионные соединения растворимы в воде, однако не все ионные соединения растворимы.Ионные соединения, растворимые в воде, существуют в растворе в ионном состоянии. На рис. 7.2 вы заметите, что хлорид натрия распадается на ион натрия и ион хлорида по мере растворения и взаимодействия с молекулами воды. В случае ионных соединений, не растворимых в воде, ионы настолько сильно притягиваются друг к другу, что не могут быть разделены частичными зарядами молекул воды. Следующая таблица может помочь вам предсказать, какие ионные соединения будут растворимы в воде.
Таблица 7.1 Правила растворимости
Диссоциация растворимых ионных соединений придает растворам этих соединений интересное свойство: они проводят электричество. Из-за этого свойства растворимые ионные соединения обозначаются как электролиты . Многие ионные соединения полностью диссоциируют и поэтому называются сильными электролитами . Хлорид натрия — пример сильного электролита.Некоторые соединения растворяются, но диссоциируют лишь частично, и растворы таких растворенных веществ могут лишь слабо проводить электричество. Эти растворенные вещества называются слабыми электролитами . Уксусная кислота (CH 3 COOH), входящая в состав уксуса, является слабым электролитом. Растворенные вещества, которые растворяются в отдельные нейтральные молекулы без диссоциации, не придают своим растворам дополнительную электропроводность и называются неэлектролитами . Полярные ковалентные соединения, такие как столовый сахар (C 12 H 22 O 11 ), являются хорошими примерами неэлектролитов .
Термин электролит используется в медицине для обозначения любых важных ионов, растворенных в водном растворе в организме. Важные физиологические электролиты включают Na + , K + , Ca 2 + , Mg 2 + и Cl — . Спортивные напитки, такие как Gatoraid, содержат комбинации этих ключевых электролитов, которые помогают восполнить потерю электролитов после тяжелой тренировки.
Аналогичным образом решения могут быть получены путем смешивания двух совместимых жидкостей.Жидкость с более низкой концентрацией называется растворенным веществом , , а жидкость с более высокой концентрацией — растворителем . Например, зерновой спирт (CH 3 CH 2 OH) представляет собой полярную ковалентную молекулу, которая может смешиваться с водой. Когда два одинаковых раствора помещаются вместе и могут смешиваться в раствор, говорят, что они смешиваются . С другой стороны, жидкости, которые не имеют сходных характеристик и не могут смешиваться вместе, называются несмешивающимися .Например, масла, содержащиеся в оливковом масле, такие как олеиновая кислота (C 18 H 34 O 2 ), имеют в основном неполярные ковалентные связи, которые не имеют межмолекулярных сил, достаточно сильных, чтобы разорвать водородную связь между молекулы воды. Таким образом, вода и масло не смешиваются и считаются несмешивающимися .
Другие факторы, такие как температура и давление, также влияют на растворимость растворителя. Таким образом, при определении растворимости следует также учитывать эти другие факторы.
(Вернуться к началу)
7,4 Температура и растворимость
При рассмотрении растворимости твердых веществ соотношение температуры и растворимости не является простым или предсказуемым. На рис. 7.3 показаны графики растворимости некоторых органических и неорганических соединений в воде в зависимости от температуры. Хотя растворимость твердого вещества обычно увеличивается с повышением температуры, нет простой взаимосвязи между структурой вещества и температурной зависимостью его растворимости.Многие соединения (такие как глюкоза и CH 3 CO 2 Na) демонстрируют резкое увеличение растворимости с повышением температуры. Другие (такие как NaCl и K 2 SO 4 ) мало изменяются, а третьи (такие как Li 2 SO 4 ) становятся менее растворимыми с повышением температуры.
Рис. 7.3. Растворимость некоторых неорганических и органических твердых веществ в воде в зависимости от температуры. Растворимость может увеличиваться или уменьшаться с температурой; величина этой температурной зависимости широко варьируется между соединениями.
Изменение растворимости в зависимости от температуры было измерено для широкого диапазона соединений, и результаты опубликованы во многих стандартных справочниках. Химики часто могут использовать эту информацию для разделения компонентов смеси путем фракционной кристаллизации , разделения соединений на основе их растворимости в данном растворителе. Например, если у нас есть смесь 150 г ацетата натрия (CH 3 CO 2 Na) и 50 г KBr, мы можем разделить два соединения, растворив смесь в 100 г воды при 80 ° C. а затем медленно охлаждают раствор до 0 ° C.Согласно температурным кривым на рисунке 7.3 оба соединения растворяются в воде при 80 ° C, и все 50 г KBr остаются в растворе при 0 ° C. Однако только около 36 г CH 3 CO 2 Na растворимо в 100 г воды при 0 ° C, поэтому кристаллизуется примерно 114 г (150 г — 36 г) CH 3 CO 2 Na при охлаждении. Затем кристаллы можно отделить фильтрованием. Таким образом, фракционная кристаллизация позволяет нам восстановить около 75% исходного CH 3 CO 2 Na в практически чистой форме всего за одну стадию.
Фракционная кристаллизация — это распространенный метод очистки таких разнообразных соединений, как показано на рис. 7.3, и от антибиотиков до ферментов. Чтобы методика работала должным образом, интересующее соединение должно быть более растворимым при высокой температуре, чем при низкой температуре, чтобы понижение температуры заставляло его кристаллизоваться из раствора. Кроме того, примеси должны быть на более растворимыми, чем представляющее интерес соединение (как KBr в этом примере), и предпочтительно присутствовать в относительно небольших количествах.
Растворимость газов в жидкостях гораздо более предсказуема. Растворимость газов в жидкостях уменьшается с повышением температуры, как показано на рисунке 7.4. Привлекательные межмолекулярные взаимодействия в газовой фазе практически равны нулю для большинства веществ, поскольку молекулы находятся так далеко друг от друга, когда находятся в газовой форме. Когда газ растворяется, это происходит потому, что его молекулы взаимодействуют с молекулами растворителя. Когда формируются эти новые силы притяжения, выделяется тепло. Таким образом, если к системе добавляется внешнее тепло, оно преодолевает силы притяжения между газом и молекулами растворителя и снижает растворимость газа.
Рис. 7.4 Зависимость растворимости нескольких обычных газов в воде от температуры при парциальном давлении 1 атм. Растворимость газов уменьшается с повышением температуры.
Уменьшение растворимости газов при более высоких температурах имеет как практические, так и экологические последствия. Любой, кто регулярно кипятит воду в чайнике или электрочайнике, знает, что внутри накапливается белый или серый налет, который в конечном итоге необходимо удалить.То же явление происходит в гораздо большем масштабе в гигантских котлах, используемых для подачи горячей воды или пара для промышленных целей, где это называется «котловая накипь», — осадок, который может серьезно снизить пропускную способность труб горячего водоснабжения ( Рисунок 7.5). Проблема не только в современном мире: акведуки, построенные римлянами 2000 лет назад для транспортировки холодной воды из альпийских регионов в более теплые и засушливые регионы на юге Франции, были забиты аналогичными отложениями. Химический состав этих отложений умеренно сложен, но движущей силой является потеря растворенного диоксида углерода (CO 2 ) из раствора.Жесткая вода содержит растворенные ионы Ca 2+ и HCO 3 — (бикарбонат). Бикарбонат кальция [Ca (HCO 3 ) 2 ] довольно растворим в воде, но карбонат кальция (CaCO 3 ) совершенно нерастворим. Раствор бикарбонат-ионов может реагировать с образованием диоксида углерода, карбонат-иона и воды:
2HCO 3 — (водн.) → CO 2 2- (водн.) + H 2 O (л) + CO 2 (водн.)
Нагревание раствора снижает растворимость CO 2 , который уходит в газовую фазу над раствором.В присутствии ионов кальция ионы карбоната осаждаются в виде нерастворимого карбоната кальция, основного компонента накипи в котле.
Рисунок 7.5 Вес котла в водопроводе. Отложения карбоната кальция (CaCO 3 ) в трубах горячего водоснабжения могут значительно снизить пропускную способность труб. Эти отложения, называемые котельной накипью, образуются, когда растворенный CO 2 переходит в газовую фазу при высоких температурах.
В разделе тепловое загрязнение озерная или речная вода, которая используется для охлаждения промышленного реактора или электростанции, возвращается в окружающую среду при более высокой температуре, чем обычно.Из-за пониженной растворимости O 2 при более высоких температурах (рис. 7.4) более теплая вода содержит меньше растворенного кислорода, чем вода, когда она попадала в растение. Рыбы и другие водные организмы, которым для жизни необходим растворенный кислород, могут буквально задохнуться, если концентрация кислорода в их среде обитания будет слишком низкой. Поскольку теплая, обедненная кислородом вода менее плотная, она имеет тенденцию плавать на поверхности более холодной, плотной и богатой кислородом воды в озере или реке, образуя барьер, препятствующий растворению атмосферного кислорода.В конце концов, если проблему не устранить, можно задохнуться даже в глубоких озерах. Кроме того, большинство рыб и других водных организмов, не являющихся млекопитающими, хладнокровны, а это означает, что температура их тела такая же, как температура окружающей среды. Температура, значительно превышающая нормальный диапазон, может привести к тяжелому стрессу или даже смерти. Системы охлаждения для электростанций и других объектов должны быть спроектированы таким образом, чтобы свести к минимуму любые неблагоприятные воздействия на температуру окружающих водоемов.На северо-западе Тихого океана популяции лососевых чрезвычайно чувствительны к изменениям температуры воды. Для этой популяции оптимальная температура воды составляет от 12,8 до 17,8 ° ° C (55-65 ° ° F). Помимо пониженного уровня кислорода, популяции лосося гораздо более восприимчивы к болезням, хищничеству и паразитарным инфекциям при более высоких температурах воды. Таким образом, тепловое загрязнение и глобальное изменение климата создают реальные проблемы для выживания и сохранения этих видов.Для получения дополнительной информации о влиянии повышения температуры на популяции лососевых посетите Focus Publication штата Вашингтон.
Похожий эффект наблюдается в повышении температуры водоемов, таких как Чесапикский залив, крупнейший эстуарий в Северной Америке, причиной которого является глобальное потепление. На каждые 1,5 ° C, которые нагревает вода в заливе, способность воды растворять кислород уменьшается примерно на 1,1%. Многие морские виды, находящиеся на южной границе своего распространения, переместили свои популяции дальше на север.В 2005 году угорь, являющийся важным местом обитания рыб и моллюсков, исчез на большей части залива после рекордно высоких температур воды. Предположительно, снижение уровня кислорода уменьшило популяцию моллюсков и других питателей, что затем уменьшило светопропускание, что позволило угрям расти. Сложные взаимоотношения в экосистемах, таких как Чесапикский залив, особенно чувствительны к колебаниям температуры, вызывающим ухудшение качества среды обитания.
(Вернуться к началу)
7.5 Влияние давления на растворимость газов: закон Генри
Внешнее давление очень мало влияет на растворимость жидкостей и твердых тел. Напротив, растворимость газов увеличивается с увеличением парциального давления газа над раствором. Эта точка проиллюстрирована на рисунке 7.6, где показано влияние повышенного давления на динамическое равновесие, которое устанавливается между молекулами растворенного газа в растворе и молекулами в газовой фазе над раствором.Поскольку концентрация молекул в газовой фазе увеличивается с увеличением давления, концентрация растворенных молекул газа в растворе в состоянии равновесия также выше при более высоких давлениях.
Рис. 7.6 Модель, показывающая, почему растворимость газа увеличивается при увеличении парциального давления при постоянной температуре. (a) Когда газ входит в контакт с чистой жидкостью, некоторые молекулы газа (пурпурные сферы) сталкиваются с поверхностью жидкости и растворяются.Когда концентрация растворенных молекул газа увеличилась так, что скорость, с которой молекулы газа уходят в газовую фазу, была такой же, как скорость, с которой они растворяются, было установлено динамическое равновесие, как показано здесь. (б) Увеличение давления газа увеличивает количество молекул газа в единице объема, что увеличивает скорость, с которой молекулы газа сталкиваются с поверхностью жидкости и растворяются. (c) По мере того, как дополнительные молекулы газа растворяются при более высоком давлении, концентрация растворенного газа увеличивается до тех пор, пока не установится новое динамическое равновесие.
Взаимосвязь между давлением и растворимостью газа количественно описывается законом Генри, названным в честь его первооткрывателя, английского врача и химика Уильяма Генри (1775–1836):
C = кПа
, где C — концентрация растворенного газа в состоянии равновесия, P — парциальное давление газа, а k — константа закона Генри , которая должна определяться экспериментально для каждой комбинации газа, растворителя, и температура.Хотя концентрацию газа можно выразить в любых удобных единицах, мы будем использовать исключительно молярность. Таким образом, единицами измерения постоянной закона Генри являются моль / (л · атм) = М / атм. Значения констант закона Генри для растворов нескольких газов в воде при 20 ° C приведены в таблице 7.2.
Видеоурок по закону Генри от Академии Кана
Все материалы Khan Academy доступны бесплатно на сайте www.khanacademy.org
Как данные в таблице 7.2 демонстрируют, что концентрация растворенного газа в воде при заданном давлении сильно зависит от ее физических свойств. Для ряда родственных веществ дисперсионные силы Лондона увеличиваются с увеличением молекулярной массы. Таким образом, среди элементов группы 18 константы закона Генри плавно возрастают от He до Ne и до Ar. Из таблицы также видно, что O 2 почти в два раза растворимее, чем N 2 . Хотя силы лондонской дисперсии слишком слабы, чтобы объяснить такую большую разницу, O 2 является парамагнитным веществом и, следовательно, более поляризуемым, чем N 2 , что объясняет его высокую растворимость.(Примечание: когда вещество парамагнитно , оно очень слабо притягивается полюсами магнита, но не сохраняет никакого постоянного магнетизма).
Таблица 7.2 Константы закона Генри для выбранных газов в воде при 20 ° C
Парциальное давление газа можно выразить как концентрацию, записав закон Генри как P газ = C / k. Это важно во многих сферах жизни, включая медицину, где обычно измеряются газы крови, такие как кислород и углекислый газ.Поскольку парциальное давление и концентрация прямо пропорциональны, если парциальное давление газа изменяется, а температура остается постоянной, новую концентрацию газа в жидкости можно легко рассчитать, используя следующее уравнение:
Где C 1 и P 1 — соответственно концентрация и парциальное давление газа в исходном состоянии, а C 2 и P 2 — концентрация и парциальное давление, соответственно, газа в конечном состоянии.Например:
Практическая задача: Концентрация CO 2 в растворе составляет 0,032 М при 3,0 атм. Какова концентрация CO 2 при давлении 5,0 атм?
Решение: Чтобы решить эту проблему, сначала мы должны определить, что мы хотим найти. Это концентрация CO 2 при давлении 5,0 атм. Эти два значения представляют C 2 = ?? и P 2 = 5.0 атм. На этом этапе проще всего будет изменить приведенное выше уравнение, чтобы найти C 2 . Далее нам нужно определить начальные условия, C 1 = 0,032 M и P 1 = 3,0 атм. Затем мы можем подставить эти значения в уравнение и решить для C 2 :
Газы, которые химически реагируют с водой, такие как HCl и другие галогениды водорода, H 2 S и NH 3 , не подчиняются закону Генри; все эти газы гораздо более растворимы, чем предсказывает закон Генри.Например, HCl реагирует с водой с образованием H + (водный) и Cl — (водный), , а не растворенных молекул HCl, и его диссоциация на ионы приводит к гораздо более высокой растворимости, чем ожидалось для нейтральной молекулы. В целом газы, вступающие в реакцию с водой, не подчиняются закону Генри.
Обратите внимание на шаблон
Закон Генри имеет важные приложения. Например, пузырьки CO 2 образуются, как только открывается газированный напиток, потому что напиток был разлит под CO 2 при давлении более 1 атм.При открытии бутылки давление CO 2 над раствором быстро падает, и часть растворенного газа улетучивается из раствора в виде пузырьков. Закон Генри также объясняет, почему аквалангисты должны быть осторожны, чтобы медленно всплывать на поверхность после погружения, если они дышат сжатым воздухом. При более высоком давлении под водой во внутренних жидкостях дайвера растворяется больше N 2 из воздуха. Если дайвер всплывает слишком быстро, быстрое изменение давления вызывает образование мелких пузырьков N 2 по всему телу, состояние, известное как «изгибы».Эти пузырьки могут блокировать кровоток по мелким кровеносным сосудам, вызывая сильную боль и даже в некоторых случаях оказываясь фатальной.
Из-за низкой константы закона Генри для O 2 в воде уровни растворенного кислорода в воде слишком низкие для удовлетворения энергетических потребностей многоклеточных организмов, включая человека. Чтобы увеличить концентрацию O 2 во внутренних жидкостях, организмы синтезируют хорошо растворимые молекулы-носители, которые обратимо связывают O 2 . Например, красные кровяные тельца человека содержат белок, называемый гемоглобином, который специфически связывает O 2 и облегчает его транспортировку из легких в ткани, где он используется для окисления молекул пищи с целью получения энергии.Концентрация гемоглобина в нормальной крови составляет около 2,2 мМ, и каждая молекула гемоглобина может связывать четыре молекулы O 2 . Хотя концентрация растворенного O 2 в сыворотке крови при 37 ° C (нормальная температура тела) составляет всего 0,010 мМ, общая концентрация растворенного O 2 составляет 8,8 мМ, что почти в тысячу раз больше, чем было бы возможно без гемоглобина. Синтетические переносчики кислорода на основе фторированных алканов были разработаны для использования в качестве экстренной замены цельной крови.В отличие от донорской крови, эти «кровезаменители» не требуют охлаждения и имеют длительный срок хранения. Их очень высокие константы закона Генри для O 2 приводят к концентрации растворенного кислорода, сравнимой с таковой в нормальной крови.
(Вернуться к началу)
7,6 Твердые гидраты:
Некоторые ионные твердые вещества принимают небольшое количество молекул воды в свою кристаллическую решетку и остаются в твердом состоянии.Эти твердые вещества называются твердыми гидратами . Твердые гидраты содержат молекулы воды, объединенные в определенном соотношении в качестве неотъемлемой части кристалла, которые либо связаны с металлическим центром, либо кристаллизовались с комплексом металла. Сообщается также, что такие гидраты содержат кристаллизационной воды или гидратной воды .
Ярким примером является хлорид кобальта (II), который при гидратации меняет цвет с синего на красный и поэтому может использоваться в качестве индикатора воды.
Рис. 7.7: Хлорид кобальта как пример твердого гидрата. Безводный хлорид кобальта (вверху слева) и его структура кристаллической решетки (внизу слева) по сравнению с гексагидратом хлорида кобальта (вверху справа) и его кристаллическая решетка (внизу справа). Обратите внимание, что молекулы воды, показанные красным (кислород) и белым (водород), интегрированы в кристаллическую решетку хлорида кобальта (II), показанного синим (кобальт) и зеленым (хлорид), в зависимости от полярности. Частично отрицательные атомы кислорода притягиваются к положительно заряженному кобальту, а частично положительные атомы водорода притягиваются к отрицательно заряженным ионам хлорида.Изображения предоставлены Wikipedia Commons (вверху слева и внизу слева), Benjah-bmm27 (вверху справа) и Smokefoot (внизу справа)
Обозначение, используемое для представления твердого гидрата: « гидратированное соединение ⋅ n H 2 O », где n — количество молекул воды на формульную единицу соли. n обычно является низким целым числом, хотя возможны дробные значения. Например, в моногидрате n равно единице, а в гексагидрате n равно 6.В примере на рис. 7.7 гидратированный хлорид кобальта будет обозначен: «хлорид кобальта (II) 6 H 2 O». Числовые префиксы греческого происхождения, которые используются для обозначения твердых гидратов:
- Hemi — 1/2
- моно — 1
- Sesqui — 1½
- Ди — 2
- Три — 3
- Тетра — 4
- Пента — 5
- Hexa — 6
- Hepta — 7
- Окта — 8
- Нона — 9
- Дека — 10
- Undeca — 11
- Додека — 12
Гидрат, потерявший воду, называют ангидридом ; оставшуюся воду, если она есть, можно удалить только при очень сильном нагревании.Вещество, не содержащее воды, обозначается как безводное . Некоторые безводные соединения настолько легко гидратируются, что вытягивают воду из атмосферы и становятся гидратированными. Эти вещества считаются гигроскопичными и могут использоваться как осушители или осушители .
(Вернуться к началу)
7.7 Концентрация раствора
В химии концентрация определяется как содержание компонента, деленное на общий объем смеси.Все мы качественно представляем, что подразумевается под концентрацией . Любой, кто варил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматный и высококонцентрированный напиток, а слишком маленькое — разбавленный раствор, который трудно отличить от воды. Количественно концентрация раствора описывает количество растворенного вещества, которое содержится в определенном количестве этого раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, протекающих в растворе, и имеет решающее значение для многих аспектов нашей жизни, от измерения правильной дозы лекарства до обнаружения химических загрязнителей, таких как свинец и мышьяк.Химики используют множество разных способов определения концентраций. В этом разделе мы рассмотрим наиболее распространенные способы представления концентрации раствора. К ним относятся: молярность и количество частей на раствор.
7.7.1 Молярность
Наиболее распространенной единицей концентрации является молярность , что также является наиболее полезным для расчетов, включающих стехиометрию реакций в растворе. Молярность (M) раствора — это количество молей растворенного вещества, присутствующего точно в 1 л раствора.
Таким образом, единицами молярности являются моль на литр раствора (моль / л), сокращенно М. Обратите внимание, что указанный объем является общим объемом раствора и включает как растворенное вещество, так и растворитель. Например, водный раствор, который содержит 1 моль (342 г) сахарозы в достаточном количестве воды, чтобы получить конечный объем 1,00 л, имеет концентрацию сахарозы 1,00 моль / л или 1,00 М. В химических обозначениях квадратные скобки вокруг названия или формула растворенного вещества представляет собой концентрацию растворенного вещества.Итак,
[сахароза] = 1,00 M
читается как «концентрация сахарозы 1,00 молярная». Приведенное выше уравнение можно использовать для расчета количества растворенного вещества, необходимого для получения любого количества желаемого раствора.
Пример проблемы:
Рассчитайте количество молей гидроксида натрия (NaOH), необходимое для получения 2,50 л 0,100 M NaOH.
Дано: (1) идентичность растворенного вещества = NaOH, (2) объема = 2,50 л и (3) молярность раствора = 0.100 моль / л (Примечание: при вычислении задач всегда записывайте единицы молярности как моль / л, а не М. Это позволит вам отменить единицы при выполнении вычислений.)
Запрошено: количество растворенного вещества в молях
Стратегия: (1) Измените приведенное выше уравнение, чтобы найти желаемую единицу, в данном случае молей. (2) Еще раз проверьте все единицы в уравнении и убедитесь, что они совпадают. Выполните все необходимые преобразования, чтобы единицы совпадали. (3) Введите значения соответствующим образом и выполните математические вычисления.
Решение:
(1) Перепишите приведенное выше уравнение, чтобы найти количество молей.
(2) Еще раз проверьте все единицы в уравнении и убедитесь, что они совпадают.
Приведенные значения для этого уравнения: объем 2,50 л и молярность 0,100 моль / л. Единицы объема для обоих этих чисел указаны в литрах (L) и, следовательно, совпадают. Следовательно, никаких преобразований производить не нужно.
(3) Введите значения соответствующим образом и выполните математические вычисления.
Подготовка растворов
Обратите внимание, что в приведенном выше примере у нас все еще недостаточно информации, чтобы фактически приготовить раствор в лаборатории. Не существует оборудования, которое могло бы измерить количество молей вещества. Для этого нам нужно преобразовать количество молей образца в количество граммов, представленное этим числом. Затем мы можем легко использовать весы для взвешивания количества вещества, необходимого для приготовления раствора.Для примера выше:
Чтобы фактически приготовить раствор, обычно растворяют растворенное вещество в небольшом количестве растворителя, а затем, когда растворенное вещество растворяется, конечный объем может быть доведен до 2,50 л. Если вы добавляете 10 г NaOH напрямую до 2,50 л конечный объем будет больше 2,50 л, а концентрация раствора будет меньше 0,100 М. Помните, что конечный объем должен включать как растворенное вещество, так и растворитель.
На рисунке 7.8 показана процедура приготовления раствора дигидрата хлорида кобальта (II) в этаноле.Обратите внимание, что объем растворителя не указан. Поскольку растворенное вещество занимает пространство в растворе, необходимый объем растворителя на меньше, чем на , чем требуемый общий объем раствора.
Рисунок 7.8: Приготовление раствора известной концентрации с использованием твердого вещества. Чтобы приготовить раствор, сначала добавьте в колбу часть растворителя. Затем взвесьте необходимое количество растворенного вещества и медленно добавьте его к растворителю.После растворения в растворителе объем раствора можно довести до конечного объема раствора. Для показанной мерной колбы это обозначено черной линией на горловине колбы. В данном случае это 500 мл раствора. Мерные колбы бывают разных размеров, чтобы вместить разные объемы раствора. Градуированные цилиндры также можно использовать для точного доведения раствора до конечного объема. Другая стеклянная посуда, включая химические стаканы и колбы Эрленмейера, недостаточно точна для большинства решений.
Пример расчета молярности
Раствор на рисунке 7.8 содержит 10,0 г дигидрата хлорида кобальта (II), CoCl 2 · 2H 2 O, в этаноле, достаточном для приготовления ровно 500 мл раствора. Какова молярная концентрация CoCl 2 · 2H 2 O?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (M)
Стратегия:
1.Мы знаем, что молярность равна
молей на литр.
2. Чтобы вычислить молярность, нам нужно выразить:
- масса в виде молей
- объем в литрах
- Подставьте оба в приведенное выше уравнение и вычислите
Решение:
- Преобразование массы в моль. Мы можем использовать молярную массу для перевода граммов CoCl 2 · 2H 2 O в моль.
- Молярная масса CoCl 2 · 2H 2 O составляет 165.87 г / моль (включая две молекулы воды, поскольку они являются частью структуры кристаллической решетки этого твердого гидрата!)
2. Перевести объем в литры
3. Подставьте значения в уравнение полярности:
7.7.2 Количество частей в решениях
В потребительском и промышленном мире наиболее распространенный метод выражения концентрации основан на количестве растворенного вещества в фиксированном количестве раствора.Упомянутые здесь «количества» могут быть выражены в массе, в объеме или и в том, и в другом (т. Е. Масса растворенного вещества в данном объеме раствора). Чтобы различать эти возможности, используются сокращения (m / м), (об / об) и (м / об).
В большинстве прикладных областей химии часто используется мера (м / м), тогда как в клинической химии обычно используется (м / об), где масса выражается в граммах и объемом в мл.
Один из наиболее распространенных способов выражения таких концентраций как « частей на 100 », который мы все знаем как « процентов ».« Cent » — это префикс латинского происхождения, относящийся к числу 100
(L. centum ), как в столетии или столетиях . Он также обозначает 1/100 (от L. centesimus ), как сантиметр и денежная единица центов . Процентные растворы определяют количество растворенного вещества, которое растворено в количестве раствора, умноженном на 100. Процентные растворы могут быть выражены в единицах массы растворенного вещества на массу раствора (м / м%) или массы растворенного вещества на объем раствора (м / об.%) или объем растворенного вещества на объем раствора (об. / об.%).При создании процентного раствора важно указать, какие единицы измерения используются, чтобы другие также могли правильно принять решение. Также помните, что раствор представляет собой сумму как растворителя, так и растворенного вещества, когда вы выполняете расчет процентов.
Раствор = Раствор + Растворитель
Таким образом, при вычислении процентных решений можно использовать следующее уравнение:
Пример 1:
В качестве примера, раствор этанола в воде с концентрацией 7,0% об. / Об. Должен содержать 7 мл этанола в общем количестве 100 мл раствора.Сколько воды в растворе?
В этой задаче мы знаем, что:
Раствор = Раствор + Растворитель
Таким образом, мы можем ввести значения, а затем решить неизвестное.
100 мл = 7 мл + X мл растворителя (в данном случае вода)
переместив 7 на другую сторону, мы увидим, что:
100 мл — 7 мл = 93 мл H 2 O
Пример 2
Какое (м / об)% раствора, если 24.0 г сахарозы растворяют в общем растворе 243 мл?
Пример 3
Сколько граммов NaCl требуется для приготовления 625 мл 13,5% раствора?
Для более разбавленных растворов используются части на миллион (10 6 ppm) и части на миллиард (10 9 ; ppb). Эти термины широко используются для обозначения количества следов загрязняющих веществ в окружающей среде.
Одинаковые процентные («части на сотню») единицы, ppm и ppb могут быть определены в единицах массы, объема или смешанных единиц массы-объема.Также существуют единицы ppm и ppb, определяемые по количеству атомов и молекул.
Массовые определения ppm и ppb приведены здесь:
Как ppm, так и ppb являются удобными единицами измерения концентраций загрязняющих веществ и других микропримесей в воде. Концентрации этих загрязнителей обычно очень низкие в очищенных и природных водах, и их уровни не могут превышать относительно низкие пороговые значения концентрации, не вызывая неблагоприятных последствий для здоровья и дикой природы.Например, EPA определило, что максимально безопасный уровень фторид-иона в водопроводной воде составляет 4 ppm. Встроенные фильтры для воды предназначены для снижения концентрации фторида и некоторых других незначительных примесей в водопроводной воде (рис. 7.9).
Рисунок 7.9. (a) В некоторых районах следовые концентрации загрязняющих веществ могут сделать нефильтрованную водопроводную воду небезопасной для питья и приготовления пищи. (б) Встроенные фильтры для воды снижают концентрацию растворенных веществ в водопроводной воде.(кредит А: модификация работы Дженн Дарфи; кредит б: модификация работы «Вастатепаркстафф» / Wikimedia commons
При сообщении о загрязнителях, таких как свинец, в питьевой воде, концентрации ppm и ppb часто указываются в смешанных единицах измерения массы / объема. Это может быть очень полезно, поскольку нам легче думать о воде с точки зрения ее объема, а не массы. Кроме того, плотность воды составляет 1,0 г / мл или 1,0 мг / 0,001 мл, что упрощает преобразование между двумя единицами измерения.Например, если мы обнаружим, что содержание свинца в воде составляет 4 ppm, это будет означать, что есть:
7,74 Эквиваленты
Концентрации ионных растворенных веществ иногда выражаются в единицах, называемых эквивалентами (уравнение). Один эквивалент равен 1 моль положительного или отрицательного заряда. Таким образом, 1 моль / л Na + (водн.) Также равен 1 экв. / Л, потому что натрий имеет заряд 1+. Раствор ионов Ca 2 + (водн.) С концентрацией 1 моль / л имеет концентрацию 2 экв / л, потому что кальций имеет заряд 2+.Разбавленные растворы могут быть выражены в миллиэквивалентах (мэкв.) — например, общая концентрация плазмы крови человека составляет около 150 мэкв / л.
В более формальном определении эквивалент — это количество вещества, необходимое для выполнения одного из следующих действий:
- реагирует или поставляет один моль ионов водорода (H + ) в кислотно-щелочной реакции
- реагирует или поставляет один моль электронов в окислительно-восстановительной реакции.
Согласно этому определению, эквивалент — это количество молей иона в растворе, умноженное на валентность этого иона.Если 1 моль NaCl и 1 моль CaCl 2 растворяются в растворе, в этом растворе содержится 1 экв. Na, 2 экв. Ca и 3 экв. Cl. (Валентность кальция равна 2, поэтому для этого иона у вас есть 1 моль и 2 эквивалента.)
(Вернуться к началу)
7,8 Разведения
Раствор желаемой концентрации можно также приготовить путем разбавления небольшого объема более концентрированного раствора дополнительным растворителем. Для этой цели часто используется основной раствор, который представляет собой приготовленный раствор известной концентрации.Разбавление основного раствора предпочтительнее при приготовлении растворов с очень слабой концентрацией, потому что альтернативный метод, взвешивание крошечных количеств растворенного вещества, может быть трудным для выполнения с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Раствор желаемой концентрации можно также приготовить путем разбавления небольшого объема более концентрированного раствора дополнительным растворителем.Для этой цели часто используется основной раствор, который представляет собой приготовленный раствор известной концентрации. Разбавление основного раствора предпочтительнее при приготовлении растворов с очень слабой концентрацией, потому что альтернативный метод, взвешивание крошечных количеств растворенного вещества, может быть трудным для выполнения с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из основного раствора показана на рисунке 7.10. Это требует расчета желаемого количества растворенного вещества в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, который содержит это количество растворенного вещества. Помните, что при разбавлении данного количества исходного раствора растворителем , а не , изменяет количество присутствующего растворенного вещества, изменяется только объем раствора. Соотношение между объемом и концентрацией основного раствора и объемом и концентрацией желаемого разбавленного раствора, таким образом, может быть выражено математически как:
Где M s — концентрация основного раствора, V s — объем основного раствора, M d — концентрация разбавленного раствора, а V d — объем разбавленного раствора. .
Рисунок 7.10 Приготовление раствора известной концентрации путем разбавления исходного раствора. (a) Объем ( V s ), содержащий желаемое количество растворенного вещества (M s ), измеряют из исходного раствора известной концентрации. (b) Отмеренный объем исходного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляется растворителем до объемной отметки [( V s ) (M s ) = ( V d ) (M d ). ].
Пример расчета разбавления
Какой объем 3,00 М исходного раствора глюкозы необходим для приготовления 2500 мл 0,400 М раствора?
Дано: объем и молярность разбавленного раствора и молярность исходного раствора
Запрошено: объем основного раствора
Стратегия и решение:
Для задач разбавления, если вам известны 3 переменные, вы можете решить для 4-й переменной.
- Начните с перестановки уравнения, чтобы найти переменную, которую вы хотите найти. В этом случае вы хотите найти объем основного раствора, V s
2. Затем убедитесь, что одинаковые термины имеют одинаковые единицы измерения. Например, Md и Ms являются концентрациями, поэтому для проведения расчетов они должны быть в одной и той же единице (в этом случае они оба указаны в молярности). Если бы концентрации были разными, скажем, один был дан в молярности, а другой в процентах, или один был в молярности, а другой был в миллимолярности, один из терминов нужно было бы преобразовать, чтобы они совпадали.Таким образом, единицы будут отменены, и в этом случае вы останетесь с единицами громкости.
3. Наконец, заполните уравнение с известными значениями и вычислите окончательный ответ.
Обратите внимание, что если требуется 333 мл исходного раствора, вы также можете рассчитать количество растворителя, необходимое для окончательного разбавления. (Общий объем — объем исходного раствора = объем растворителя, необходимый для окончательного разбавления. В этом случае 2500 мл — 333 мл = 2167 мл воды, необходимой для окончательного разбавления (это следует делать в мерном цилиндре или мерной колбе) .
(Вернуться к началу)
7,9 Концентрации ионов в растворе
До сих пор мы обсуждали концентрацию всего раствора в терминах общего растворенного вещества, деленного на объем раствора. Давайте более подробно рассмотрим, что это означает при рассмотрении ионных и ковалентных соединений. Когда ионные соединения растворяются в растворе, они переходят в ионное состояние.Катионы и анионы связываются с полярными молекулами воды. Напомним, что растворы, содержащие ионы, называются электролитами из-за их способности проводить электричество. Например, дихромат аммония (NH 4 ) 2 Cr 2 O 7 представляет собой ионное соединение, которое содержит два иона NH 4 + и один ион Cr 2 O 7 2− ион на формульную единицу. Как и другие ионные соединения, это сильный электролит, который диссоциирует в водном растворе с образованием гидратированных ионов NH 4 + и Cr 2 O 7 2-.Если мы рассмотрим это решение математически, мы увидим, что для каждой молекулы дихромата аммония, которая растворяется, образуются три результирующих иона (два иона NH 4 + и один Cr 2 O 7 2- ион). Это также можно представить в более крупном молярном масштабе. Когда 1 моль (NH 4 ) 2 Cr 2 O 7 растворяется, образуется 3 моля ионов (1 моль Cr 2 O 7 2- анионов и 2 моль катионов NH 4 + ) в растворе (рисунок 7.11). Чтобы обсудить взаимосвязь между концентрацией раствора и результирующим количеством ионов, используется термин эквивалента .
Один эквивалент определяется как количество ионного соединения, которое обеспечивает 1 моль электрического заряда (+ или -). Он рассчитывается путем деления молярности раствора на общий заряд, созданный в растворе.
Рис. 7.11 Растворение 1 моля ионного соединения. Растворение 1 моля формульных единиц дихромата аммония в воде дает 1 моль анионов Cr 2 O 7 2- и 2 моль катионов NH 4 + . (Молекулы воды не показаны с молекулярной точки зрения для ясности.)
Когда мы проводим химическую реакцию с использованием раствора соли, например дихромата аммония, нам необходимо знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 M (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2- также должна быть равна 1.43 M, потому что на формульную единицу приходится один ион Cr 2 O 7 2-. Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 М. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 образует трех ионов при растворении в воде (2NH 4 + + 1Cr 2 O 7 2-), общая концентрация ионов в решение 3 × 1.43 M = 4,29 M. Эквивалентное значение (NH 4 ) 2 Cr 2 O 7 можно затем рассчитать, разделив 1,43 M на 4,29 M, получив 0,333 эквивалента. Таким образом, для (NH 4 ) 2 Cr 2 O 7 растворение 0,333 моля соединения даст 1 моль ионов в растворе.
Пример 1
Каковы концентрации всех ионных частиц, полученных из растворенных веществ в этих водных растворах?
- 0.21 М NaOH
- 3,7 M (CH 3 ) CHOH
- 0,032 M In (NO 3 ) 3
Дано: молярность
Запрошено: концентрации
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или как неэлектролит.
B Если соединение неэлектролит, его концентрация равна молярности раствора. Если соединение является сильным электролитом, определите количество каждого иона, содержащегося в одной формульной единице.Найдите концентрацию каждого вида, умножив количество каждого иона на молярность раствора.
Решение:
1. 0,21 М NaOH
A Гидроксид натрия — это ионное соединение, которое является сильным электролитом (и сильным основанием) в водном растворе:
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH —, концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0.21 M и [OH — ] = 0,21
2. 3,7 M (CH 3 ) CHOH
A Формула (CH 3 ) 2 CHOH представляет собой 2-пропанол (изопропиловый спирт) и содержит группу –OH, поэтому это спирт. Напомним из раздела 4.1 «Водные растворы», что спирты — это ковалентные соединения, которые растворяются в воде с образованием растворов нейтральных молекул. Таким образом, спирты не являются электролитами
B Таким образом, единственным растворенным веществом в растворе является (CH 3 ) 2 молекул CHOH, поэтому [(CH 3 ) 2 CHOH] = 3.7 Месяцев
3. 0,032 M дюйм (NO 3 ) 3
A Нитрат индия — это ионное соединение, которое содержит ионы In 3+ и ионы NO 3 —, поэтому мы ожидаем, что он будет вести себя как сильный электролит в водном растворе
B Одна формульная единица In (NO 3 ) 3 дает один ион In 3+ и три иона NO 3 —, так что 0,032 M In (NO 3 ) 3 Решение содержит 0.032 M In 3+ и 3 × 0,032 M = 0,096 M NO 3 — , то есть [In 3+ ] = 0,032 M и [NO 3 — ] = 0,096 M
(Вернуться к началу)
7.10 Внимание к окружающей среде: загрязнение свинцом
История использования свинца в США
В главе 5 вы познакомились с EPA и с тем, как параметры качества воздуха отслеживаются для определения уровней загрязнения.Одним из шести основных параметров, за которым ведется мониторинг в соответствии с Законом о чистом воздухе, является свинец. Свинец естественным образом встречается в земной коре в очень низких концентрациях, ~ 0,001%, и выглядит как сине-серый металл, мягкий и плотный. Он широко используется в Соединенных Штатах во многих различных продуктах, включая батареи и смеси металлов, в качестве материала для пайки труб и керамики, хрусталя и других известных коммерческих продуктов. Особенно часто свинец использовался в красках для наружных работ и в качестве добавки к бензину (рис.7.12). Из-за растущих проблем со здоровьем использование свинца во многих продуктах было прекращено и прекращено. Однако загрязнение свинцом почвы, воды и воздуха по-прежнему является проблемой и вызывает повышенный риск для здоровья населения.
Рисунок 7.12 История использования свинца в красках и бензине на протяжении большей части 20 века. На графике показано, как вначале преобладали краски на основе свинца, после чего последовал бум в транспортировке, что привело к высокому использованию этилированного бензина.Спад после середины 1970-х годов был связан с контролем, введенным EPA для исключения этилированного бензина. Источник: Filippelli и др. (2005) использовано с разрешения.
Национальные стандарты качества окружающего воздуха (NAAQS) для свинца установлены на верхнем пределе 0,15 микрограмм на кубический метр Pb в общем количестве взвешенных частиц в среднем за 3 месяца. Как видно из рисунка 7.13, уровни свинца в атмосфере были очень высокими до середины 1990-х годов, после чего мы наблюдали резкое падение уровней свинца в атмосфере.Этот всплеск содержания свинца в значительной степени связан с выбросами транспортных средств, когда свинец использовался в качестве добавки к бензину. В 1970 году, когда было полностью признано отрицательное воздействие свинца на здоровье, Агентство по охране окружающей среды начало программу сокращения использования свинца в бензине. Полный запрет на этилированный бензин вступил в силу в 1996 году.
Рис. 7.13 Уровни содержания свинца в атмосфере с 1980 по 2014 год. (A) Как интерпретировать графики качества воздуха от EPA. синяя полоса показывает распределение уровней загрязнения воздуха по участкам тренда, отображая средние 80%.Белая линия представляет собой среднее значение по всем сайтам трендов. Девяносто процентов участков имеют концентрации ниже верхней линии, в то время как десять процентов участков имеют концентрации ниже нижней линии. (B) Максимальный годовой максимальный трехмесячный средний уровень содержания свинца в атмосфере, демонстрирующий снижение уровня загрязнения свинцом на 99% с 1980 по 2017 год. Источник: EPA
Использование тетраэтилсвинца (TEL) было определено General Motors в качестве присадки к топливу, которая увеличивает общее октановое число бензина.Это позволило значительно повысить компрессию двигателя, что привело к увеличению производительности автомобиля и большей экономии топлива.
TEL получают путем реакции хлорэтана с натрием — свинцом сплавом
4 NaPb + 4 CH 3 CH 2 Cl → (CH 3 CH 2 ) 4 Pb + 4 NaCl + 3 Pb
Продукт регенерируется путем перегонки с водяным паром, в результате чего остается ил из отходов свинца и хлорида натрия.Несмотря на десятилетия исследований, не было обнаружено никаких реакций, улучшающих этот довольно сложный процесс, который включает металлический натрий и превращает только 25% свинца в TEL. ТЕЛ — вязкая бесцветная жидкость. Поскольку TEL является нейтральным по заряду и содержит внешние углеродные группы, он является липофильным, (жиро-любящим) и растворимым в бензине.
При сжигании этилированного бензина выделяется не только диоксид углерода и вода, но и свинец.
(CH 3 CH 2 ) 4 Pb + 13 O 2 → 8 CO 2 + 10 H 2 O + Pb
Образующийся свинец также может окисляться при сгорании с образованием оксида свинца (II)
2 Pb + O 2 → 2 PbO
Образование Pb и PbO внутри автомобильного двигателя быстро чрезмерно накапливается и вызывает серьезные повреждения двигателя.Таким образом, молекулы, улавливающие свинец, также должны были быть добавлены в бензин для реакции с продуктами свинца, образующимися при сгорании. Обычно для этого процесса использовались 1,2-дибромэтан и 1,2-дихлорэтан. Эти агенты реагируют с побочными продуктами свинца и образуют летучий бромид свинца (II) и хлорид свинца (II), которые затем могут быть выброшены в атмосферу из двигателя.
Повышенные уровни свинца в атмосфере, вызванные использованием автомобилей, сильно коррелировали с повышенными уровнями свинца в крови среди населения.
7.14 Снижение среднего уровня свинца в крови у детей в США и общего количества свинца, использованного в год в бензине в 1974-1992 годах (адаптировано из U.S.EPA 1999).
Биологические эффекты свинца
После того, как свинец попадает в организм, он не выводится из организма. Вместо этого он накапливается в минерализующихся тканях, таких как кости и зубы, или в мягких тканях, таких как печень, почки и мозг. Мозг очень чувствителен. Проведенное в Цинциннати исследование продемонстрировало, что воздействие свинца в детстве вызывает потерю серого вещества в мозге, особенно в лобных областях, участвующих в исполнительной функции и принятии решений (рис.7.15).
Рис. 7.15. Воздействие свинца в детстве уменьшает размер мозга. Мозг взрослых, подвергшихся воздействию свинца в детстве, показывает уменьшенный объем, особенно в префронтальной коре на МРТ. Области потери объема показаны цветом на шаблоне нормального мозга. Источник: Cecil, KM, et al.
Острое воздействие свинца может вызвать отравление свинцом и вызвать боли в животе, запоры, головные боли, раздражительность, проблемы с памятью, неспособность иметь детей и покалывание в руках и ногах.Это вызывает почти 10% умственной отсталости по другой неизвестной причине и может привести к поведенческим проблемам. Некоторые эффекты постоянны. В тяжелых случаях возможны анемия, судороги, кома или смерть.
Воздействие свинца может происходить через загрязненный воздух, воду, пыль, продукты питания или товары широкого потребления что они едят. Воздействие свинца на работе — частая причина отравления свинцом у взрослых людей определенных профессий, которым грозит особый риск.Диагноз обычно ставится путем измерения уровня свинца в крови. Центры по контролю за заболеваниями (США) установили верхний предел содержания свинца в крови для взрослых на уровне 10 мкг / дл (10 мкг / 100 г) и для детей на уровне 5 мкг / дл.
Интересная корреляция: преступность и уровни свинца в крови
Ряд исследований, проведенных за последнее десятилетие, показали сильную корреляцию между уровнем свинца в крови дошкольного возраста и последующим уровнем преступности, особенно насильственных преступлений, произошедших 20 лет спустя (Рисунок 7.16).
Рис. 7.16. Соотношение уровней содержания свинца в крови в дошкольном возрасте и насильственных преступлений, совершенных 23 года спустя.
В начале 1990-х годов убийства и насильственные преступления достигли рекордного уровня, которому не видно конца. Однако к концу 1990-х годов количество насильственных преступлений по стране сократилось на 40%. Было предложено множество гипотез этого быстрого спада, включая увеличение количества заключенных и увеличение количества полицейских.Однако уровни свинца в крови показывают очень сильную корреляцию с частотой насильственных преступлений с запаздыванием примерно в 20 лет. Кроме того, исследования на животных, в том числе на хомяках и кошках, показали, что воздействие свинца увеличивает или усиливает агрессивное поведение. Кроме того, данные, собранные Риком Невином из других стран (Франция, Западная Германия, Италия и Австралия), которые имеют разные уровни тюремного заключения и контроля, показывают аналогичные тенденции в насильственных преступлениях с уровнями свинца в крови у детей.Таким образом, есть убедительные доказательства того, что повышенное воздействие свинца в детстве в результате употребления этилированного бензина объясняет, по крайней мере частично, рост уровня насильственных преступлений в 1980-х и начале 1990-х годов в Соединенных Штатах.
Текущие проблемы и опасения
Несмотря на то, что за последние 40-50 лет использование свинца резко сократилось, он все еще может быть обнаружен в повышенных концентрациях в почвах, особенно в городских и промышленных районах.Кроме того, свинец ранее использовался для строительства водопроводных труб, поскольку он прочен и податлив. Свинец больше не используется для строительства труб, но в более старых городах, таких как Флинт, все еще есть свинцовые трубы, а также медные и железные водопроводные трубы, в стыках и соединениях которых использовалась свинцовая пайка. В апреле 2014 года это стало серьезной проблемой для жителей Флинта, штат Мичиган. Город Флинт, штат Мичиган, столкнулся с серьезными финансовыми проблемами и, пытаясь сэкономить деньги, решил построить новый водопровод от озера Гурон для обеспечения питьевой водой этого района.Экономия затрат оценивалась примерно в 10 миллионов долларов в год. Однако на строительство трубопровода уйдет несколько лет. Таким образом, чтобы сразу же сэкономить деньги, город Флинт решил временно переключить городскую воду на реку Флинт на время завершения строительства нового трубопровода. Однако с речной водой может быть труднее справиться из-за более сильных колебаний в остатках стока, и почти сразу жители Флинта, штат Мичиган, начали жаловаться на неприятный запах и неконтролируемую цветную воду, идущую из кранов (рис.7.17).
Рисунок 7.17. Ли-Энн Уолтерс демонстрирует образцы водопроводной воды на публичном собрании в январе 2015 года. Источник: Ladapo, J.A, et. al. (2017).
Анализ воды первоначально показал высокий уровень фекальных колиформных бактерий, из-за чего Флинт, штат Мичиган, выпустил рекомендации по кипячению и увеличил количество хлора, используемого для обработки воды. Это, в свою очередь, увеличило производство тригалометанов. Тригалометаны образуются в результате реакции хлорных дезинфицирующих средств в воде с присутствующими органическими веществами, такими как те, которые образуются водорослями, присутствующими в реке Флинт.Тригалометаны связаны со многими проблемами со здоровьем, включая проблемы с печенью, почками и легкими, а также создают неприятный запах и привкус воды. Они также опасны при вдыхании, делая душ в горячей загрязненной воде серьезным риском для здоровья.
Таким образом, в попытке уменьшить образование побочных продуктов тригалогенметана, город Флинт начал добавлять в воду больше FeCl 3 , чтобы помочь удалить дополнительные органические материалы из этого источника воды.Однако они не смогли добавить никаких молекул, контролирующих коррозию, таких как ортофосфат. Многие водоочистные сооружения используют низкие концентрации ортофосфатов для взаимодействия со свинцом в трубах и образования нерастворимого фосфата свинца, который не проникает в водопровод (рис. 7.18). Отсутствие контроля над коррозией со стороны города Флинт в сочетании с повышенным количеством FeCl 3 привело к резкому увеличению количества присутствующих ионов Cl —. Результатом было общее увеличение потенциала коррозии, измеренное по массовому отношению хлорида к сульфату, от 0.45 для системы водоснабжения Детройта до 1,60 для новой системы водоснабжения реки Флинт. Имея такой потенциал коррозии, молекулы кислорода в воде начали окисляться и выделять растворимые формы свинца в водную систему (рис. 7.18). В дополнение к окисленным побочным продуктам свинца выделялись окисленные формы железа, вызывающие большее обесцвечивание воды.
Рис. 7.18. Процесс коррозии во время водного кризиса во Флинте, штат Мичиган.
Чтобы получить интерактивную анимацию этого химического процесса, посмотрите этот
Видео журнала Scientific American — Коррозионная химия: как свинец попал в питьевую воду Флинта
Из-за протеста общественности и отказа города Флинта принимать меры в связи с плохим качеством воды, компания Virgina Tech начала программу тестирования воды и обнаружила чрезвычайно высокие уровни свинца во многих домах во Флинте, штат Мичиган.CDC заявляет, что не существует безопасных уровней свинца, которые можно было бы употреблять, а стандарты EPA ограничивают содержание свинца в питьевой воде до 15 частей на миллиард. Самый высокий образец, зарегистрированный Технологическим институтом штата Вирджиния, составил 13 000 частей на миллиард из образца в доме Ли-Энн Уолтерс (рис. 7.17). Город Флинт вернулся к использованию системы водоснабжения Детройта в октябре 2015 года. Однако риск воздействия свинца на детей, находящихся в этом районе, превышающий установленные CDC предельные уровни в крови, за это время увеличился вдвое (рис. 7.19). Несколько судебных исков, находящихся на рассмотрении, в настоящее время находятся в стадии рассмотрения из-за халатности властей города Флинт и органов, регулирующих качество воды в регионе.
Рисунок 7.19. Сравнение уровней свинца в крови во Флинте, штат Мичиган, до и после переключения на источник воды реки Флинт. Верхняя диаграмма показывает, что качество воды в 1 из 6 домов во Флинте, штат Мичиган, проверено выше пределов безопасности EPA для свинца после перехода на источник воды в реке Флинт. Нижняя панель показывает уровни свинца в крови у детей, регулярно проверяемые на уровни свинца в крови в районе как до, так и после перехода на новый источник воды. Источник: исследование Flint Water Study
.
Предлагаемое задание: Учителя могут загрузить дискуссионное задание на тему «Экологическая несправедливость и влияние токсичного загрязнения воды во Флинте, штат Мичиган,
».
Flint Water Crisis Environmental Justice Assignment
7.11 Резюме
Чтобы убедиться, что вы понимаете материал этой главы, вам следует проанализировать значения терминов, выделенных жирным шрифтом в следующем резюме, и спросить себя, как они соотносятся с темами в главе.
Раствор представляет собой однородную смесь. Основным компонентом является растворитель , а второстепенным компонентом — растворенное вещество . Решения могут иметь любую фазу; например, сплав представляет собой твердый раствор.Растворенные вещества представляют собой растворимых или нерастворимых , что означает, что они растворяются или не растворяются в конкретном растворителе. Термины смешивающийся и несмешивающийся вместо «растворимый и нерастворимый» используются для жидких растворенных веществ и растворителей. Утверждение « как растворяется как » является полезным руководством для прогнозирования того, будет ли растворенное вещество растворяться в данном растворителе.
Растворение происходит путем сольватации , процесса, в котором частицы растворителя окружают отдельные частицы растворенного вещества, разделяя их с образованием раствора.Для водных растворов используется слово гидратация . Если растворенное вещество является молекулярным, оно растворяется на отдельные молекулы. Если растворенное вещество является ионным, отдельные ионы отделяются друг от друга, образуя раствор, который проводит электричество. Такие растворы называются электролитами . Если диссоциация ионов завершена, раствор представляет собой сильный электролит . Если диссоциация только частичная, раствор представляет собой слабый электролит . Растворы молекул не проводят электричество и называются неэлектролитами .
Количество растворенного вещества в растворе представлено концентрацией раствора. Максимальное количество растворенного вещества, которое будет растворяться в данном количестве растворителя, называется растворимостью растворенного вещества. Таких решений насыщенных . Растворы, у которых количество меньше максимального, — это ненасыщенных . Большинство растворов являются ненасыщенными, и их концентрацию можно указать разными способами. Массовый / массовый процент , объемный / объемный процент и массовый / объемный процент указывают процент растворенного вещества в общем растворе. частей на миллион (ppm) и частей на миллиард (ppb) используются для описания очень малых концентраций растворенного вещества. Молярность , определяемая как количество молей растворенного вещества на литр раствора, является стандартной единицей концентрации в химической лаборатории. Эквиваленты выражают концентрации в молях заряда ионов. Когда раствор разбавляется, мы используем тот факт, что количество растворенного вещества остается постоянным, чтобы можно было определить объем или концентрацию конечного разбавленного раствора.Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора (маточный раствор ) до желаемого конечного объема.
Ключевые вынос
- Концентрации раствора обычно выражаются в виде молярности и могут быть получены путем растворения известной массы растворенного вещества в растворителе или разбавления исходного раствора.
Концептуальные проблемы
Какое из представлений лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- NH 3
- HF
- CH 3 CH 2 CH 2 OH
Na 2 SO 4
Какое из представлений, показанных в задаче 1, лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- CH 3 CO 2 H
- NaCl
- Na 2 S
- Na 3 PO 4
- ацетальдегид
Ожидаете ли вы, что 1,0 М раствор CaCl 2 будет лучше проводить электричество, чем 1,0 М раствор NaCl? Почему или почему нет?
Альтернативный способ определения концентрации раствора — моляльность , сокращенно м .Моляльность определяется как количество молей растворенного вещества в 1 кг растворителя . Чем это отличается от молярности? Ожидаете ли вы, что 1 M раствор сахарозы будет более или менее концентрированным, чем 1 m раствор сахарозы? Поясните свой ответ.
Каковы преимущества использования решений для количественных расчетов?
Ответ
a) Nh4 — слабое основание, что означает, что некоторые молекулы будут принимать протон от молекул воды, заставляя их диссоциировать на ионы H + и -OH.Ион H + будет ассоциироваться с Nh4 с образованием Nh5 +. Таким образом, это будет больше всего похоже на стакан №2. б) HF — слабая кислота, хотя F сильно электроотрицателен. Это связано с тем, что молекула H-F может образовывать прочные водородные связи с молекулами воды и оставаться в ковалентной связи, которую труднее диссоциировать. Таким образом, стакан № 2 также является хорошим выбором для этой молекулы, так как только часть H-F будет диссоциировать на ионы h4O + и F-. c) CH 3 CH 2 CH 2 OH является ковалентным соединением и не будет диссоциировать в какой-либо заметной степени, поэтому стакан № 3 является правильным выбором.г) Na 2 SO 4 — это растворимое ионное соединение, которое полностью диссоциирует на ионы, больше всего напоминающее химический стакан № 1.
Да, потому что когда CaCl 2 диссоциирует, он образует 3 иона (1 иона Ca 2+ и 2 иона Cl —), тогда как NaCl будет диссоциировать только на 2 иона (Na + и Cl —) для каждой молекулы. Таким образом, CaCl 2 будет генерировать больше ионов на моль, чем 1 моль NaCl, и будет лучше проводить электричество.
Если количество вещества, необходимое для реакции, слишком мало для точного взвешивания, использование раствора вещества, в котором растворенное вещество диспергировано в гораздо большей массе растворителя, позволяет химикам измерить количество вещества. вещество, точнее.
Числовые задачи
Рассчитайте количество граммов растворенного вещества в 1.000 л каждого раствора.
- 0,2593 M NaBrO 3
- 1.592 М КНО 3
- 1,559 М уксусная кислота
- 0,943 M йодат калия
Рассчитайте количество граммов растворенного вещества в 1.000 л каждого раствора.
- 0,1065 млн бай 2
- 1,135 M Na 2 SO 4
- 1,428 M NH 4 Br
- 0,889 М ацетат натрия
Если все растворы содержат одно и то же растворенное вещество, какой раствор содержит большую массу растворенного вещества?
- 1.40 л 0,334 М раствора или 1,10 л 0,420 М раствора
- 25,0 мл 0,134 М раствора или 10,0 мл 0,295 М раствора
- 250 мл 0,489 М раствора или 150 мл 0,769 М раствора
Заполните следующую таблицу для 500 мл раствора.
Соединение Масса (г) Родинки Концентрация (M) сульфат кальция 4,86 уксусная кислота 3.62 дигидрат иодистого водорода 1,273 бромид бария 3,92 глюкоза 0,983 ацетат натрия 2,42 Какая концентрация каждого вида присутствует в следующих водных растворах?
- 0,489 моль NiSO 4 в 600 мл раствора
- 1.045 моль бромида магния в 500 мл раствора
- 0,146 моль глюкозы в 800 мл раствора
- 0,479 моль CeCl 3 в 700 мл раствора
Какая концентрация каждого вида присутствует в следующих водных растворах?
- 0,324 моль K 2 MoO 4 в 250 мл раствора
- 0,528 моль формиата калия в 300 мл раствора
- 0,477 моль KClO 3 в 900 мл раствора
- 0.378 моль йодида калия в 750 мл раствора
Какова молярная концентрация каждого раствора?
- 8,7 г бромида кальция в 250 мл раствора
- 9,8 г сульфата лития в 300 мл раствора
- 12,4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора
- 14,2 г гексагидрата нитрата железа (III) в 300 мл раствора
Какова молярная концентрация каждого раствора?
- 12.8 г гидросульфата натрия в 400 мл раствора
- 7,5 г гидрофосфата калия в 250 мл раствора
- 11,4 г хлорида бария в 350 мл раствора
- 4,3 г винной кислоты (C 4 H 6 O 6 ) в 250 мл раствора
Укажите концентрацию каждого реагента в следующих уравнениях, принимая 20,0 г каждого и объем раствора 250 мл для каждого реагента.
- BaCl 2 (водн.) + Na 2 SO 4 (водн.) →
- Ca (OH) 2 (водн.) + H 3 PO 4 (водн.) →
- Al (NO 3 ) 3 (водн.) + H 2 SO 4 (водн.) →
- Pb (NO 3 ) 2 (водн.) + CuSO 4 (водн.) →
- Al (CH 3 CO 2 ) 3 (водн.) + NaOH (водн.) →
На эксперимент потребовалось 200.0 мл 0,330 М раствора Na 2 CrO 4 . Для приготовления этого раствора использовали исходный раствор Na 2 CrO 4 , содержащий 20,0% растворенного вещества по массе с плотностью 1,19 г / см 3 . Опишите, как приготовить 200,0 мл 0,330 М раствора Na 2 CrO 4 , используя исходный раствор.
Гипохлорит кальция [Ca (OCl) 2 ] — эффективное дезинфицирующее средство для одежды и постельного белья. Если раствор имеет концентрацию Ca (OCl) 2 , равную 3.4 г на 100 мл раствора, какова молярность гипохлорита?
Фенол (C 6 H 5 OH) часто используется в качестве антисептика в жидкостях для полоскания рта и леденцах для горла. Если в жидкости для полоскания рта концентрация фенола составляет 1,5 г на 100 мл раствора, какова молярность фенола?
Если таблетка, содержащая 100 мг кофеина (C 8 H 10 N 4 O 2 ), растворяется в воде с получением 10,0 унций раствора, какова молярная концентрация кофеина в растворе?
На этикетке определенного лекарства есть инструкция по добавлению 10.0 мл стерильной воды, заявив, что каждый миллилитр полученного раствора будет содержать 0,500 г лекарства. Если пациенту назначена доза 900,0 мг, сколько миллилитров раствора следует ввести?
ответы
а. 39,13 г б. 161,0 г c. 93,57 г г. 201,8 г
а. 1,40 л 0,334 М раствора, б. 25,0 мл 0,134 М раствора, c. 150 мл 0,769 М раствора
а.0.815 М, г. 2.09 М, c. 0.182 М, д. 0,684 M
а. 0.174 М, г. 0.297 М, c. 0,048 М, д. 0,135 млн
а. BaCl 2 = 0,384 M, Na 2 SO 4 = 0,563 M, б. Ca (OH) 2 = 1.08 M, h4PO4 = 0.816 M, c. Al (NO 3 ) 3 = 0,376 M, H 2 SO 4 = 0,816 M, d. Pb (NO 3 ) 2 = 0,242 M, CuSO 4 = 0,501 M, т.е. Al (CH 3 CO 2 ) = 0.392 M, NaOH = 2,00 M
1,74 × 10 −3 M кофеин
(Вернуться к началу)
7.12 Ссылки
- Chung (Peter) Chieh (2016) Неорганическая химия. Либретекстов . Доступно по адресу: https://chem.libretexts.org/Core/Inorganic_Chemistry/Chemical_Reactions/Chemical_Reactions_1/Solutions
- Болл, Д.У., Хилл, Дж. У. и Скотт, Р. Дж. (2016) MAP: Основы общей, органической и биологической химии . Свободные тексты. Доступно по адресу: https://chem.libretexts.org/Textbook_Maps/Introductory_Chemistry_Textbook_Maps/Map%3A_The_Basics_of_GOB_Chemistry_(Ball_et_al.)
- Аверилл Б.А., Элдридж П. (2012) Принципы химии . Свободные тексты. Доступно по адресу: https://2012books.lardbucket.org/books/principles-of-general-chemistry-v1.0/index.html
- Гидрат. (2017, 30 августа).В Википедия, Бесплатная энциклопедия . Получено 16:20, 26 сентября 2017 г., с https://en.wikipedia.org/w/index.php?title=Hydrate&oldid=798015169
- Лоуэр, С. (2010). Растворы 1: Растворы и их концентрации. В онлайн-учебнике «Виртуальный учебник Chem1». Доступно по адресу: http://www.chem1.com/acad/webtext/solut/solut-1.html
- Мичиганская сеть по охране окружающей среды детей (2013 г.) Здоровье окружающей среды детей в Мичигане.Вики по гигиене окружающей среды. Проверено 6 сентября 2018 г. по адресу: http://wiki.mnceh.org/index.php/Neurotoxicity:_Lead
- авторов Википедии. (2018, 5 сентября). Отравление свинцом. В Википедия, Бесплатная энциклопедия . Получено 02:05, 7 сентября 2018 г., с https://en.wikipedia.org/w/index.php?title=Lead_poisoning&oldid=858177302
- Ladapo, J.A., Mohammed, A.K., and Nwosu, V.C. (2017) Загрязнение свинцом во Флинте, Мичиган, США и других городах. Международный журнал экологического и научного образования, 11 (5): 1341-1351.Открытый доступ. Доступно по адресу: www.ijese.net/makale_indir/1899
.
.
.
.